よむ、つかう、まなぶ。
資料1-3(参考資料1) 日本パブリックアフェアーズ協会 御提出資料 (26 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2310_04medical/231211/medical03_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第3回 12/11)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
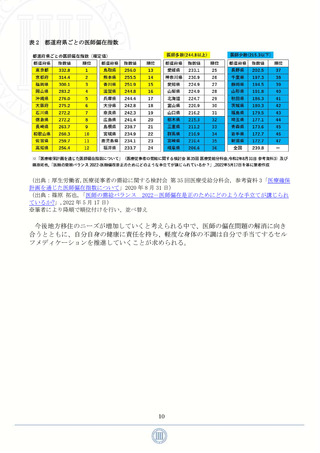
に全会一致の廃止など評価検討会議の運用のあり方が見直されてきた。人の生命に影響を
及ぼす医薬品について議論を尽くすことは当然なこととして、どのようなことを議論する
のかといった論点や議論終結の判断基準、審議期間の設定は諸外国との“スイッチラグ”
解消には不可欠のことと考える。また、日本のスイッチ OTC 医薬品の承認スキームは評価
検討会議での検討後に薬事・食品衛生審議会の要指導・一般用医薬品部会が行われ承認の
可否を審議することとなっている 44(図 14)。一方で、有効性と安全性を一から評価する
新薬の承認審査は製薬企業からの申請後約 1 年で完了する。つまり、ある程度有効性と安
全性のデータが集積されているスイッチ OTC 医薬品の承認審査は、承認可否の審議前に評
価検討会議とパブリックコメントを通過する必要があり、新薬の承認審査よりも承認まで
のステップが多い構造になっている 44,45(図 14,15)。これらの問題を踏まえて、本レポー
トにおける具体的な提言は第 7 章で述べることとする。
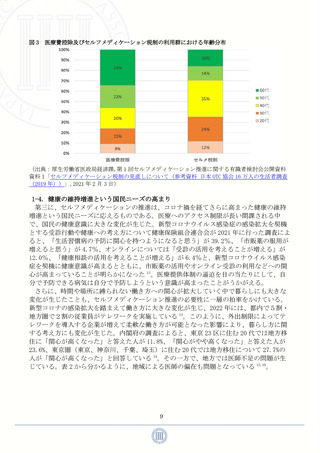
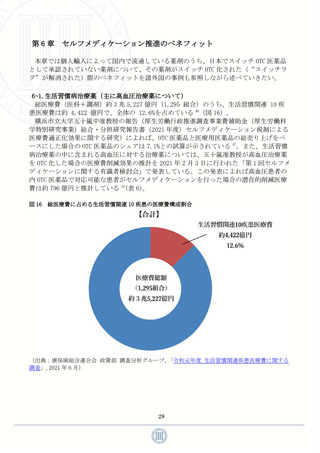
図 14
スイッチ OTC 医薬品に係る承認審査の標準的フロー
(出典:厚生労働省,第 23 回 医療用から要指導・一般用への転用に関する評価検討会議公開資料 資料
1「検討会議における検討の進め方について」,2022 年 12 月 26 日)
26
及ぼす医薬品について議論を尽くすことは当然なこととして、どのようなことを議論する
のかといった論点や議論終結の判断基準、審議期間の設定は諸外国との“スイッチラグ”
解消には不可欠のことと考える。また、日本のスイッチ OTC 医薬品の承認スキームは評価
検討会議での検討後に薬事・食品衛生審議会の要指導・一般用医薬品部会が行われ承認の
可否を審議することとなっている 44(図 14)。一方で、有効性と安全性を一から評価する
新薬の承認審査は製薬企業からの申請後約 1 年で完了する。つまり、ある程度有効性と安
全性のデータが集積されているスイッチ OTC 医薬品の承認審査は、承認可否の審議前に評
価検討会議とパブリックコメントを通過する必要があり、新薬の承認審査よりも承認まで
のステップが多い構造になっている 44,45(図 14,15)。これらの問題を踏まえて、本レポー
トにおける具体的な提言は第 7 章で述べることとする。
図 14
スイッチ OTC 医薬品に係る承認審査の標準的フロー
(出典:厚生労働省,第 23 回 医療用から要指導・一般用への転用に関する評価検討会議公開資料 資料
1「検討会議における検討の進め方について」,2022 年 12 月 26 日)
26