よむ、つかう、まなぶ。
別紙4○先進医療Bに係る新規技術の科学的評価等について (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00066.html |
| 出典情報 | 先進医療会議(第129回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
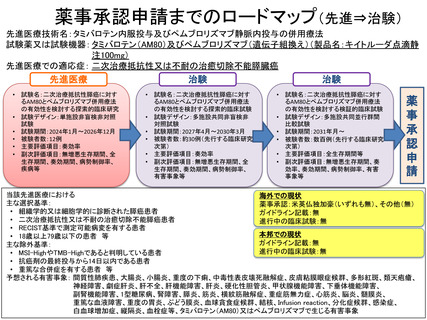
本臨床研究では、二次治療抵抗性膵癌患者を対象にタミバロテン(AM80)と ICI で
あるペムブロリズマブ(遺伝子組換え)を併用投与した時の有効性を探索的に評価し、
安全性を確認することを目的とする。
○主要評価項目:
奏効率(Response rate:RR)
○副次評価項目:
1)無増悪生存期間(Progression free survival:PFS)
2)全生存期間(Overall survival:OS)
3)奏効期間(Duration of Response:DOR)及び完全奏効期間
4)病勢制御率(Disease Control Rate:DCR)
○安全性評価項目
1)特定臨床研究の実施に起因するものと疑われる疾病、障害もしくは死亡又は
感染症(疾病等)
2)バイタルサイン・臨床検査値・酸素飽和度
○予定試験期間:2024 年3月~2026 年 12 月
○目標症例数:12 例
(効果)
本臨床研究により腫瘍縮小効果が期待でき、生存期間の延長が期待される。
(先進医療にかかる費用)
二次治療抵抗性膵癌患者に対するタミバロテン(AM80)とペムブロリズマブの投与
にかかる総費用は8コースで、3,907,384 円である。
申請医療機関
名古屋大学医学部附属病院
協力医療機関
なし
2.先進医療技術審査部会における審議概要
【第1回目審議】
(1)開催日時:令和5年 11 月9日(木)
(第 155 回
16:00~
先進医療技術審査部会)
(2)議事概要
名古屋大学医学部附属病院から申請のあった新規医療技術について、申請書類を基
に、有効性・安全性等に関する評価が行われた。
審議の結果、当該技術を「継続審議」とし、構成員からの指摘について修正を行い、
再度、本会議にて審議することとした。
(本会議での評価結果)
(別紙1)第 155 回先進医療技術審査部会資料1-2、1-3参照
11
あるペムブロリズマブ(遺伝子組換え)を併用投与した時の有効性を探索的に評価し、
安全性を確認することを目的とする。
○主要評価項目:
奏効率(Response rate:RR)
○副次評価項目:
1)無増悪生存期間(Progression free survival:PFS)
2)全生存期間(Overall survival:OS)
3)奏効期間(Duration of Response:DOR)及び完全奏効期間
4)病勢制御率(Disease Control Rate:DCR)
○安全性評価項目
1)特定臨床研究の実施に起因するものと疑われる疾病、障害もしくは死亡又は
感染症(疾病等)
2)バイタルサイン・臨床検査値・酸素飽和度
○予定試験期間:2024 年3月~2026 年 12 月
○目標症例数:12 例
(効果)
本臨床研究により腫瘍縮小効果が期待でき、生存期間の延長が期待される。
(先進医療にかかる費用)
二次治療抵抗性膵癌患者に対するタミバロテン(AM80)とペムブロリズマブの投与
にかかる総費用は8コースで、3,907,384 円である。
申請医療機関
名古屋大学医学部附属病院
協力医療機関
なし
2.先進医療技術審査部会における審議概要
【第1回目審議】
(1)開催日時:令和5年 11 月9日(木)
(第 155 回
16:00~
先進医療技術審査部会)
(2)議事概要
名古屋大学医学部附属病院から申請のあった新規医療技術について、申請書類を基
に、有効性・安全性等に関する評価が行われた。
審議の結果、当該技術を「継続審議」とし、構成員からの指摘について修正を行い、
再度、本会議にて審議することとした。
(本会議での評価結果)
(別紙1)第 155 回先進医療技術審査部会資料1-2、1-3参照
11