よむ、つかう、まなぶ。
別紙4○先進医療Bに係る新規技術の科学的評価等について (50 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00066.html |
| 出典情報 | 先進医療会議(第129回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
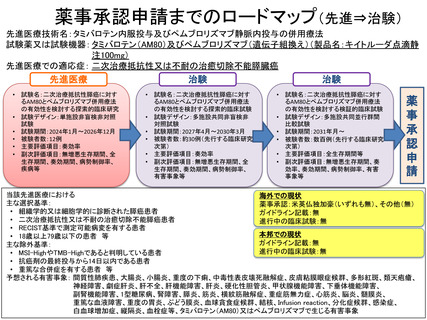
【別添3】
「タミバロテン内服投与及びペムブロリズマブ静脈内投与の併用療法」
の被験者の適格基準及び選定方法(申請書類より抜粋)
5.被験者の適格基準及び選定方法
選択基準:
1) 膵癌取り扱い規約第 7 版に基づき、組織学的又は細胞学的に診断された膵癌患者
2) 二次治療抵抗性(2 種類の標準的治療に対して抵抗性)又は不耐の治癒切除不能膵癌患者(再発を
含む)
(再発例については、手術時の術前・術後化学療法は標準治療の数にカウントしない)
3) スクリーニング時の造影 CT により、RECIST 基準で測定可能病変を有する患者
4) 生検可能な病変を一つ以上有し、生検が行えると研究責任医師又は分担医師が判断した患者
5) 同意取得時に ECOG の PS が 0~1 で経口剤を服用できる患者
6) AM80 投与開始日より 12 週以上の生存が期待できる患者
7) スクリーニング時の主要臓器機能が以下の基準を満たしている患者
① 好中球数:1,500/μL 以上
② 血小板数:100,000/μL 以上
③ Hb:9.0g/dL 以上
④ 総ビリルビン:施設基準値上限の 1.5 倍以下(ただし、原疾患による閉塞性黄疸や肝転移がある場合
には、施設基準値上限の 3 倍以下とする)
⑤ AST・ALT:施設基準値上限の 3 倍以下(ただし、原疾患による閉塞性黄疸や肝転移がある場合は施
設基準値上限の 5 倍以下)
⑥ Cr が施設基準値上限の 1.5 倍以下、あるいは Cr が施設基準値上限の 1.5 倍を超える場合、CrCl が 30
mL/min 以上
⑦ INR 又は PT・aPTT 又は PTT:施設基準値上限の 1.5 倍以下
8) 男性患者で、AM80 投与開始から AM80 投与終了後 6 ヵ月間避妊できる男性患者、あるいは妊娠す
る可能性のある女性の場合で AM80 投与開始 30 日前から AM80 投与終了後 2 年間避妊できる女性
患者
9) 同意取得時に 18 歳以上 79 歳以下の患者(性別は問わない)
10) 本臨床研究について十分な説明を受けた後、患者本人の自由意思による文書同意が得られた患者
除外基準
1) MSI-High や TMB-High であると判明している患者
2) 登録時に抗癌剤(化学療法、免疫療法、バイオ療法等)の最終投与から 14 日以内である患者
3) 登録前 14 日以内に、他の臨床試験に参加し、臨床研究に用いる医薬品等の最終投与から 14 日以内
である患者
4) 前治療による有害事象の状態が安定していない患者
5) 中枢神経系への転移を有する患者
6) 無病期間が 1 年未満の重複癌を有する患者
7) 過去にビタミン A 製剤を投与したことがある、ビタミン A 製剤を投与中である、あるいはビタミ
ン A を含有するサプリメントを常用している患者
8) 登録前 4 週間以内に全身麻酔を伴う手術を受けた患者
50
「タミバロテン内服投与及びペムブロリズマブ静脈内投与の併用療法」
の被験者の適格基準及び選定方法(申請書類より抜粋)
5.被験者の適格基準及び選定方法
選択基準:
1) 膵癌取り扱い規約第 7 版に基づき、組織学的又は細胞学的に診断された膵癌患者
2) 二次治療抵抗性(2 種類の標準的治療に対して抵抗性)又は不耐の治癒切除不能膵癌患者(再発を
含む)
(再発例については、手術時の術前・術後化学療法は標準治療の数にカウントしない)
3) スクリーニング時の造影 CT により、RECIST 基準で測定可能病変を有する患者
4) 生検可能な病変を一つ以上有し、生検が行えると研究責任医師又は分担医師が判断した患者
5) 同意取得時に ECOG の PS が 0~1 で経口剤を服用できる患者
6) AM80 投与開始日より 12 週以上の生存が期待できる患者
7) スクリーニング時の主要臓器機能が以下の基準を満たしている患者
① 好中球数:1,500/μL 以上
② 血小板数:100,000/μL 以上
③ Hb:9.0g/dL 以上
④ 総ビリルビン:施設基準値上限の 1.5 倍以下(ただし、原疾患による閉塞性黄疸や肝転移がある場合
には、施設基準値上限の 3 倍以下とする)
⑤ AST・ALT:施設基準値上限の 3 倍以下(ただし、原疾患による閉塞性黄疸や肝転移がある場合は施
設基準値上限の 5 倍以下)
⑥ Cr が施設基準値上限の 1.5 倍以下、あるいは Cr が施設基準値上限の 1.5 倍を超える場合、CrCl が 30
mL/min 以上
⑦ INR 又は PT・aPTT 又は PTT:施設基準値上限の 1.5 倍以下
8) 男性患者で、AM80 投与開始から AM80 投与終了後 6 ヵ月間避妊できる男性患者、あるいは妊娠す
る可能性のある女性の場合で AM80 投与開始 30 日前から AM80 投与終了後 2 年間避妊できる女性
患者
9) 同意取得時に 18 歳以上 79 歳以下の患者(性別は問わない)
10) 本臨床研究について十分な説明を受けた後、患者本人の自由意思による文書同意が得られた患者
除外基準
1) MSI-High や TMB-High であると判明している患者
2) 登録時に抗癌剤(化学療法、免疫療法、バイオ療法等)の最終投与から 14 日以内である患者
3) 登録前 14 日以内に、他の臨床試験に参加し、臨床研究に用いる医薬品等の最終投与から 14 日以内
である患者
4) 前治療による有害事象の状態が安定していない患者
5) 中枢神経系への転移を有する患者
6) 無病期間が 1 年未満の重複癌を有する患者
7) 過去にビタミン A 製剤を投与したことがある、ビタミン A 製剤を投与中である、あるいはビタミ
ン A を含有するサプリメントを常用している患者
8) 登録前 4 週間以内に全身麻酔を伴う手術を受けた患者
50