よむ、つかう、まなぶ。
別紙4○先進医療Bに係る新規技術の科学的評価等について (55 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00066.html |
| 出典情報 | 先進医療会議(第129回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【別添6】
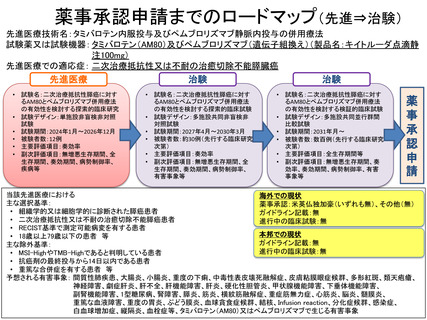
「タミバロテン内服投与及びペムブロリズマブ静脈内投与の併用療法」
の治療計画(申請書類より抜粋)
6.治療計画
本臨床研究では、選択基準を満たし、除外基準に該当しない二次治療抵抗性(2 種類の標準的治療に
対して抵抗性)又は不耐の治癒切除不能膵癌患者に説明し、同意を文書で取得する。全ての対象者に非
盲検下で AM80 として 6mg/m2 を 1 日 2 回に分けて、ペムブロリズマブの投与 1 週間前から投与開始前
まで 7 日間経口投与し、AM80 の投与終了後、ペムブロリズマブとして 1 回 200mg を、3 週間間隔で点
滴静注する。3 週間(21 日間)を 1 コースとし、病勢進行、もしくは許容できない有害事象等が発現す
るまで、最大 8 コース継続する。
造影 CT は 4 週間以上の間隔を空け撮像し、腫瘍縮小効果の評価を行う。主要評価項目は、奏効率
(RR)であり、副次評価項目として、無増悪生存期間(PFS)
、全生存期間(OS)
、奏効期間(DOR)及
び完全奏効期間、病勢制御率(DCR)である。
なお、膵癌患者に対し AM80 とペムブロリズマブを併用するのは初めてであるため、安全性(忍容
性)の評価を目的とした中間解析を行うこととする。
1コース目の評価が3例終了した時点で、2コース目開始日の評価まで(1コース目で中止した場合
は、治療終了・中止時の評価)の安全性のデータを纏める。また、3例目の2コース目開始日の評価ま
で(1コース目で中止した場合は、治療終了・中止時の評価)に対象者に生じた、疾病等に該当する有
害事象で、重篤な有害事象に該当する事項、並びに治療中止基準のうちAM80又はペムブロリズマブの
投与が継続できない疾病等に該当する事項を一覧にする。対象者に生じた、疾病等に該当する有害事
象で、重篤な有害事象の項に該当する事項、並びに治療中止基準のうちAM80又はペムブロリズマブの
投与が継続できない疾病等に該当する事項を総合的に勘案し、試験継続の可否について、審議し、研
究責任医師に勧告する。当該疾病等のうち同一の疾病等が2例に発生した場合は、中止の勧告も検討す
ることとする。
安全性評価委員会で審議された結果を先進医療技術審査部会に報告し、先進医療の継続可否について
評価を受ける。先進医療技術審査部会による登録初期 3 例の評価が完了するまで、症例登録を一時中断
することとする。
55
「タミバロテン内服投与及びペムブロリズマブ静脈内投与の併用療法」
の治療計画(申請書類より抜粋)
6.治療計画
本臨床研究では、選択基準を満たし、除外基準に該当しない二次治療抵抗性(2 種類の標準的治療に
対して抵抗性)又は不耐の治癒切除不能膵癌患者に説明し、同意を文書で取得する。全ての対象者に非
盲検下で AM80 として 6mg/m2 を 1 日 2 回に分けて、ペムブロリズマブの投与 1 週間前から投与開始前
まで 7 日間経口投与し、AM80 の投与終了後、ペムブロリズマブとして 1 回 200mg を、3 週間間隔で点
滴静注する。3 週間(21 日間)を 1 コースとし、病勢進行、もしくは許容できない有害事象等が発現す
るまで、最大 8 コース継続する。
造影 CT は 4 週間以上の間隔を空け撮像し、腫瘍縮小効果の評価を行う。主要評価項目は、奏効率
(RR)であり、副次評価項目として、無増悪生存期間(PFS)
、全生存期間(OS)
、奏効期間(DOR)及
び完全奏効期間、病勢制御率(DCR)である。
なお、膵癌患者に対し AM80 とペムブロリズマブを併用するのは初めてであるため、安全性(忍容
性)の評価を目的とした中間解析を行うこととする。
1コース目の評価が3例終了した時点で、2コース目開始日の評価まで(1コース目で中止した場合
は、治療終了・中止時の評価)の安全性のデータを纏める。また、3例目の2コース目開始日の評価ま
で(1コース目で中止した場合は、治療終了・中止時の評価)に対象者に生じた、疾病等に該当する有
害事象で、重篤な有害事象に該当する事項、並びに治療中止基準のうちAM80又はペムブロリズマブの
投与が継続できない疾病等に該当する事項を一覧にする。対象者に生じた、疾病等に該当する有害事
象で、重篤な有害事象の項に該当する事項、並びに治療中止基準のうちAM80又はペムブロリズマブの
投与が継続できない疾病等に該当する事項を総合的に勘案し、試験継続の可否について、審議し、研
究責任医師に勧告する。当該疾病等のうち同一の疾病等が2例に発生した場合は、中止の勧告も検討す
ることとする。
安全性評価委員会で審議された結果を先進医療技術審査部会に報告し、先進医療の継続可否について
評価を受ける。先進医療技術審査部会による登録初期 3 例の評価が完了するまで、症例登録を一時中断
することとする。
55