よむ、つかう、まなぶ。
別紙4○先進医療Bに係る新規技術の科学的評価等について (47 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00066.html |
| 出典情報 | 先進医療会議(第129回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
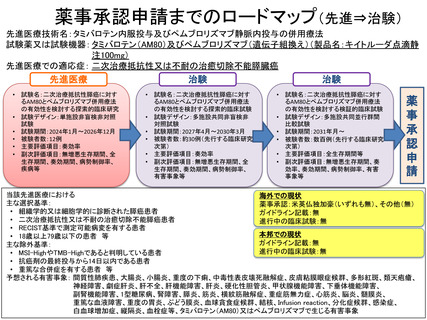
薬事承認申請までのロードマップ(先進⇒治験)
先進医療技術名:タミバロテン内服投与及びペムブロリズマブ静脈内投与の併用療法
試験薬又は試験機器: タミバロテン(AM80)及びペムブロリズマブ(遺伝子組換え)(製品名:キイトルーダ点滴静
注100mg)
先進医療での適応症: 二次治療抵抗性又は不耐の治癒切除不能膵臓癌
先進医療
治験
治験
• 試験名:二次治療抵抗性膵癌に対す
るAM80とペムブロリズマブ併用療法
の有効性を検討する探索的臨床研究
• 試験デザイン:単施設非盲検非対照
試験
• 試験期間:2024年1月~2026年12月
• 被験者数:12例
• 主要評価項目:奏効率
• 副次評価項目:無増悪生存期間、全
生存期間、奏効期間、病勢制御率、
疾病等
• 試験名:二次治療抵抗性膵癌に対す
るAM80とペムブロリズマブ併用療法
の有効性を検討する探索的臨床試験
• 試験デザイン:多施設共同非盲検非
対照試験
• 試験期間:2027年4月~2030年3月
• 被験者数:約30例(先行する臨床研究
次第)
• 主要評価項目:奏効率
• 副次評価項目:無増悪生存期間、全
生存期間、奏効期間、病勢制御率、
有害事象等
• 試験名:二次治療抵抗性膵癌に対す
るAM80とペムブロリズマブ併用療法
の有効性を検討する検証的臨床試験
• 試験デザイン:多施設共同並行群間
比較試験
• 試験期間:2031年月~
• 被験者数:数百例(先行する臨床研究
次第)
• 主要評価項目:全生存期間等
• 副次評価項目:無増悪生存期間、奏
効率、奏効期間、病勢制御率、有害
事象等
薬
事
承
認
申
請
当該先進医療における
海外での現状
主な選択基準:
薬事承認:米英仏独加豪(いずれも無)、その他(無)
• 組織学的又は細胞学的に診断された膵癌患者
ガイドライン記載:無
• 二次治療抵抗性又は不耐の治癒切除不能膵癌患者
進行中の臨床試験:無
• RECIST基準で測定可能病変を有する患者
本邦での現状
• 18歳以上79歳以下の患者 等
ガイドライン記載:無
主な除外基準:
進行中の臨床試験:無
• MSI-HighやTMB-Highであると判明している患者
• 抗癌剤の最終投与から14日以内である患者
• 重篤な合併症を有する患者 等
予想される有害事象: 間質性肺疾患、大腸炎、小腸炎、重度の下痢、中毒性表皮壊死融解症、皮膚粘膜眼症候群、多形紅斑、類天疱瘡、
神経障害、劇症肝炎、肝不全、肝機能障害、肝炎、硬化性胆管炎、甲状腺機能障害、下垂体機能障害、
副腎機能障害、1型糖尿病、腎障害、膵炎、筋炎、横紋筋融解症、重症筋無力症、心筋炎、脳炎、髄膜炎、
重篤な血液障害、重度の胃炎、ぶどう膜炎、血球貪食症候群、結核、Infusion
reaction、分化症候群、感染症、
47
白血球増加症、縦隔炎、血栓症等、タミバロテン(AM80)又はペムブロリズマブで生じる有害事象
先進医療技術名:タミバロテン内服投与及びペムブロリズマブ静脈内投与の併用療法
試験薬又は試験機器: タミバロテン(AM80)及びペムブロリズマブ(遺伝子組換え)(製品名:キイトルーダ点滴静
注100mg)
先進医療での適応症: 二次治療抵抗性又は不耐の治癒切除不能膵臓癌
先進医療
治験
治験
• 試験名:二次治療抵抗性膵癌に対す
るAM80とペムブロリズマブ併用療法
の有効性を検討する探索的臨床研究
• 試験デザイン:単施設非盲検非対照
試験
• 試験期間:2024年1月~2026年12月
• 被験者数:12例
• 主要評価項目:奏効率
• 副次評価項目:無増悪生存期間、全
生存期間、奏効期間、病勢制御率、
疾病等
• 試験名:二次治療抵抗性膵癌に対す
るAM80とペムブロリズマブ併用療法
の有効性を検討する探索的臨床試験
• 試験デザイン:多施設共同非盲検非
対照試験
• 試験期間:2027年4月~2030年3月
• 被験者数:約30例(先行する臨床研究
次第)
• 主要評価項目:奏効率
• 副次評価項目:無増悪生存期間、全
生存期間、奏効期間、病勢制御率、
有害事象等
• 試験名:二次治療抵抗性膵癌に対す
るAM80とペムブロリズマブ併用療法
の有効性を検討する検証的臨床試験
• 試験デザイン:多施設共同並行群間
比較試験
• 試験期間:2031年月~
• 被験者数:数百例(先行する臨床研究
次第)
• 主要評価項目:全生存期間等
• 副次評価項目:無増悪生存期間、奏
効率、奏効期間、病勢制御率、有害
事象等
薬
事
承
認
申
請
当該先進医療における
海外での現状
主な選択基準:
薬事承認:米英仏独加豪(いずれも無)、その他(無)
• 組織学的又は細胞学的に診断された膵癌患者
ガイドライン記載:無
• 二次治療抵抗性又は不耐の治癒切除不能膵癌患者
進行中の臨床試験:無
• RECIST基準で測定可能病変を有する患者
本邦での現状
• 18歳以上79歳以下の患者 等
ガイドライン記載:無
主な除外基準:
進行中の臨床試験:無
• MSI-HighやTMB-Highであると判明している患者
• 抗癌剤の最終投与から14日以内である患者
• 重篤な合併症を有する患者 等
予想される有害事象: 間質性肺疾患、大腸炎、小腸炎、重度の下痢、中毒性表皮壊死融解症、皮膚粘膜眼症候群、多形紅斑、類天疱瘡、
神経障害、劇症肝炎、肝不全、肝機能障害、肝炎、硬化性胆管炎、甲状腺機能障害、下垂体機能障害、
副腎機能障害、1型糖尿病、腎障害、膵炎、筋炎、横紋筋融解症、重症筋無力症、心筋炎、脳炎、髄膜炎、
重篤な血液障害、重度の胃炎、ぶどう膜炎、血球貪食症候群、結核、Infusion
reaction、分化症候群、感染症、
47
白血球増加症、縦隔炎、血栓症等、タミバロテン(AM80)又はペムブロリズマブで生じる有害事象