よむ、つかう、まなぶ。
別紙4○先進医療Bに係る新規技術の科学的評価等について (38 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00066.html |
| 出典情報 | 先進医療会議(第129回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
先進医療審査の事前照会事項に対する回答 5
先進医療技術名: タミバロテン内服投与及びペムブロリズマブ静脈内投与の併用療法
2023 年 10 月 31 日
所属・氏名:名古屋大学医学部附属病院・川嶋 啓揮
1. 照会事項 1 の回答において、
「現在、ICI を保有する企業から開発に向けた確約がとれていな
い」とのことですが、本 POC 的位置づけの臨床試験を実施した後に、後投与とする ICI は
ペンブロリズマブ以外の薬剤となる可能性があると理解してよいか。
いずれの ICI が選択されたとしても、今後、PMDA と開発戦略を含めた相談を行うと考えら
れますが、現時点で、本剤と ICI の適切な用量設定を検討するための臨床試験を実施する予
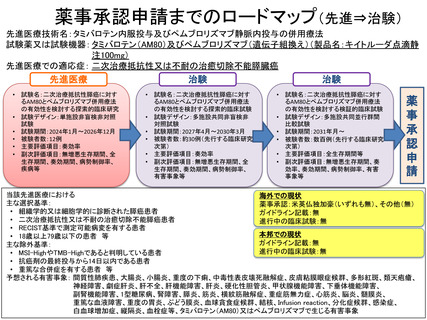
定の有無とその詳細について説明するとともに、ロードマップでは、次に探索的試験(治験)
を想定していますが、検証的試験が不要と考えている根拠を説明してください。また、ロー
ドマップを修正する必要があるかについても検討してください。
以上を踏まえ、本試験を自由診療ではなく先進医療 B として実施する意義や理由について
説明してください。
【回答】
免疫チェックポイント阻害剤(ICI)を保有する企業との交渉次第となり、他の薬剤の可能性も
あると思います。
用量設定については、今回の成績次第ではありますが、安全性上大きな問題がなく、一定の有
効性が期待できれば、膵癌が有効な治療方法がない難治癌であることを勘案すると、開発を迅速
に進めるため、今回の臨床研究で使用される用量で検証的な臨床試験に移行するのも一つの開発
戦略と考えています。一方、一定の有効性が確認された上で、さらに適切な有効性・安全性を確
認するために用量設定を検討するのも戦略であると考えております。いずれの戦略にするかは、
得られる試験成績と開発を受け入れる企業、医薬品医療機器総合機構との相談の上で決定するこ
とになります。
ロードマップについては、検証的試験を実施しない意図はありませんでした。検証的試験を追
加したロードマップに差し替えます。
本併用療法である AM80 と ICI を併用する臨床試験は、世界で初めての臨床試験であることか
ら、その実施については自由診療としてではなく、先進医療として審議・評価を受けた上で実施
し、得られた結果も先進医療会議等で評価いただくことが適切ではないかと考え、申請しました。
以上
1
38
先進医療技術名: タミバロテン内服投与及びペムブロリズマブ静脈内投与の併用療法
2023 年 10 月 31 日
所属・氏名:名古屋大学医学部附属病院・川嶋 啓揮
1. 照会事項 1 の回答において、
「現在、ICI を保有する企業から開発に向けた確約がとれていな
い」とのことですが、本 POC 的位置づけの臨床試験を実施した後に、後投与とする ICI は
ペンブロリズマブ以外の薬剤となる可能性があると理解してよいか。
いずれの ICI が選択されたとしても、今後、PMDA と開発戦略を含めた相談を行うと考えら
れますが、現時点で、本剤と ICI の適切な用量設定を検討するための臨床試験を実施する予
定の有無とその詳細について説明するとともに、ロードマップでは、次に探索的試験(治験)
を想定していますが、検証的試験が不要と考えている根拠を説明してください。また、ロー
ドマップを修正する必要があるかについても検討してください。
以上を踏まえ、本試験を自由診療ではなく先進医療 B として実施する意義や理由について
説明してください。
【回答】
免疫チェックポイント阻害剤(ICI)を保有する企業との交渉次第となり、他の薬剤の可能性も
あると思います。
用量設定については、今回の成績次第ではありますが、安全性上大きな問題がなく、一定の有
効性が期待できれば、膵癌が有効な治療方法がない難治癌であることを勘案すると、開発を迅速
に進めるため、今回の臨床研究で使用される用量で検証的な臨床試験に移行するのも一つの開発
戦略と考えています。一方、一定の有効性が確認された上で、さらに適切な有効性・安全性を確
認するために用量設定を検討するのも戦略であると考えております。いずれの戦略にするかは、
得られる試験成績と開発を受け入れる企業、医薬品医療機器総合機構との相談の上で決定するこ
とになります。
ロードマップについては、検証的試験を実施しない意図はありませんでした。検証的試験を追
加したロードマップに差し替えます。
本併用療法である AM80 と ICI を併用する臨床試験は、世界で初めての臨床試験であることか
ら、その実施については自由診療としてではなく、先進医療として審議・評価を受けた上で実施
し、得られた結果も先進医療会議等で評価いただくことが適切ではないかと考え、申請しました。
以上
1
38