よむ、つかう、まなぶ。
別紙4○先進医療Bに係る新規技術の科学的評価等について (53 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00066.html |
| 出典情報 | 先進医療会議(第129回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【別添5】
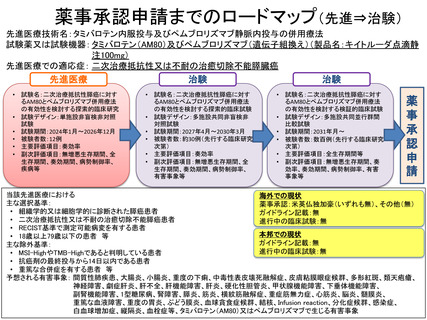
「タミバロテン内服投与及びペムブロリズマブ静脈内投与の併用療法」
の予定の試験期間及び症例数(申請書類より抜粋)
7-2.予定の試験期間及び症例数
予定試験期間:
臨床研究全体の実施期間:2024 年 1 月 1 日~2026 年 12 月 31 日
症例登録期間:2024 年 1 月 1 日~2025 年 12 月 31 日
対象者の臨床研究期間:約 20 週間
予定症例数:12
既に実績のある症例数:0
①有効性が認められた事例
区分
病名
治療経過
年 月 日
歳
(至)
性別 男・女
他
転帰
(自)
整理番号 1
年齢
入院期間
年 月 日
例(病名ごとに記載すること)
②有効性が認められなかった事例、安全上の問題が発生した事例
区分
病名
整理番号 1
年齢
歳
性別 男・女
他
入院期間
転帰
治療経過
(自)
年 月 日
(至)
年 月 日
例(病名ごとに記載すること)
予定試験期間及び予定症例数の設定根拠:
予定症例数の設定根拠:
標準療法に不応又は不耐の治癒切除不能膵癌患者に対する二次治療における TS-1 の成績は、2.8%
の奏効率であった(Oncology. 96(1):1-7, 2019)。本臨床研究は、二次治療抵抗性又は標準療法に不耐の
治癒切除不能膵癌患に対し、三次治療としての AM80 と ICI であるペムブロリズマブの有効性を確認
する臨床研究であり、30%程度の奏効率が認められれば、臨床的に意味があると判断した。
以上のことから、閾値奏効率を 2.8%、期待奏効率を 30%と仮定し、有意水準(片側)5%、検出力
80%とすると必要症例数は 10 例となる。中止・脱落を 10%程度見積もると、目標症例数は 12 例とな
る。
53
「タミバロテン内服投与及びペムブロリズマブ静脈内投与の併用療法」
の予定の試験期間及び症例数(申請書類より抜粋)
7-2.予定の試験期間及び症例数
予定試験期間:
臨床研究全体の実施期間:2024 年 1 月 1 日~2026 年 12 月 31 日
症例登録期間:2024 年 1 月 1 日~2025 年 12 月 31 日
対象者の臨床研究期間:約 20 週間
予定症例数:12
既に実績のある症例数:0
①有効性が認められた事例
区分
病名
治療経過
年 月 日
歳
(至)
性別 男・女
他
転帰
(自)
整理番号 1
年齢
入院期間
年 月 日
例(病名ごとに記載すること)
②有効性が認められなかった事例、安全上の問題が発生した事例
区分
病名
整理番号 1
年齢
歳
性別 男・女
他
入院期間
転帰
治療経過
(自)
年 月 日
(至)
年 月 日
例(病名ごとに記載すること)
予定試験期間及び予定症例数の設定根拠:
予定症例数の設定根拠:
標準療法に不応又は不耐の治癒切除不能膵癌患者に対する二次治療における TS-1 の成績は、2.8%
の奏効率であった(Oncology. 96(1):1-7, 2019)。本臨床研究は、二次治療抵抗性又は標準療法に不耐の
治癒切除不能膵癌患に対し、三次治療としての AM80 と ICI であるペムブロリズマブの有効性を確認
する臨床研究であり、30%程度の奏効率が認められれば、臨床的に意味があると判断した。
以上のことから、閾値奏効率を 2.8%、期待奏効率を 30%と仮定し、有意水準(片側)5%、検出力
80%とすると必要症例数は 10 例となる。中止・脱落を 10%程度見積もると、目標症例数は 12 例とな
る。
53