よむ、つかう、まなぶ。
【資料1-1】 医薬品等行政評価・監視委員会における海外調査の状況 (10 ページ)
出典
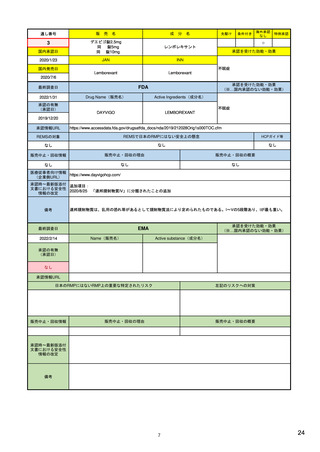
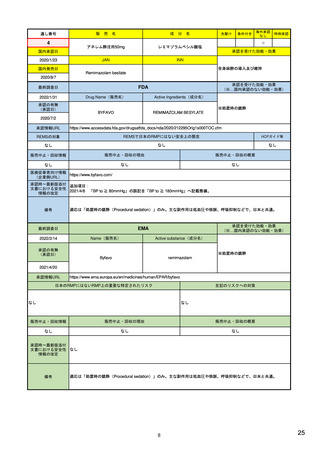
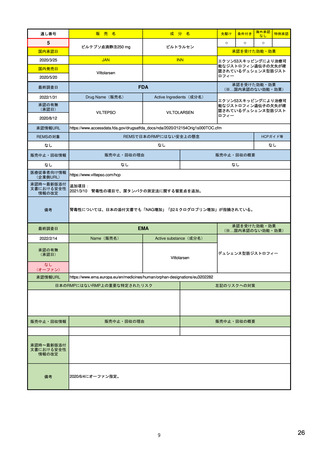
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
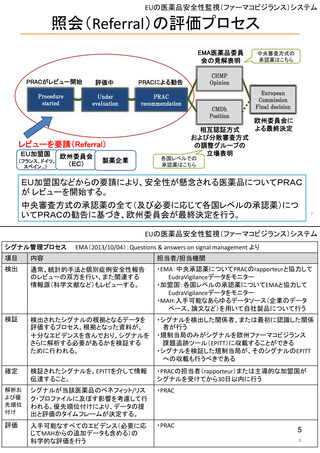
EMA PRACの議事内容の最近の例
2022.2.7~10会議より
• ヒドロキシデンプン(HES)輸液のEU全体での販売停止を勧告
―腎障害/死亡のリスクを最小化するため多くの使用制限・措置が実施された
が、レビューの結果、推奨外の使用が認められたため。
• JAK阻害薬トファシチニブの安全性レビュー
―心臓リスクのある患者では癌、血栓、死亡のリスクが高かった。
• mRNAワクチン(コミナティ、スパイクバックス)と月経障害
―前回のレビューで因果関係を支持しないと結論したが、文献および自発報告
を考慮し再度評価した。因果関係はまだ明らかではない。
• COVID-19ワクチンのリスク管理計画(RMP)に関するガイダンスを
改訂
• 妊娠中または授乳中にインフリキシマブに曝露された乳児への
生ワクチンの使用を延期するよう助言
―インフリキシマブは胎盤を通過し、母乳中にも低レベルで検出される。
17
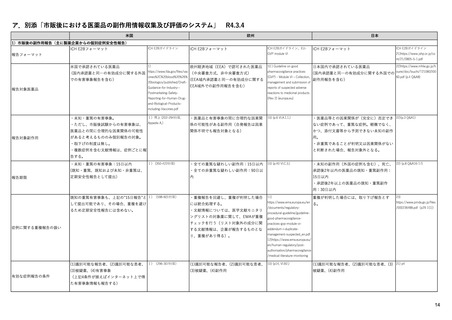
米国の市販後安全対策担当部局
保健福祉省(HHS)
Department of Health and Human Services
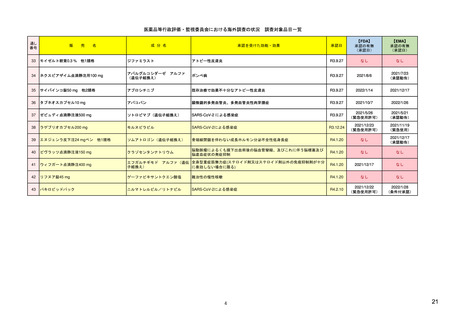
監察総監室(OIG)
食品医薬品庁(FDA)
Office of Inspector General
Food and Drug Administration
独立かつ客観的な監督機関。これまでに、
FDAに対してさまざまな調査・評価を行い、
OIGレポートを発行している。
例)『FDAには、リスク評価・軽減対策(REMS)が医薬
品安全性を向上させているか判断するための包括
的なデータが不足している』 (Report OEI-04-11-0051
02-12-2013)
Center for Drug Evaluation & Research
生物製品評価研究センター
(CBER)
医療機器・放射線保健
センター(CDRH)
Center for Biologics Evaluation & Research
Center for Device & Radiological Health
監視・疫学部(OSE)
生物統計・疫学部(OBE)
製品評価・品質部(OPEQ)
Office of Surveillance & Epidemiology
Office of Biostatistics & Epidemiology
Office of Product Evaluation & Quality
医薬品評価研究センター(CDER)
シグナル検出、評価等の担当
10
18
2022.2.7~10会議より
• ヒドロキシデンプン(HES)輸液のEU全体での販売停止を勧告
―腎障害/死亡のリスクを最小化するため多くの使用制限・措置が実施された
が、レビューの結果、推奨外の使用が認められたため。
• JAK阻害薬トファシチニブの安全性レビュー
―心臓リスクのある患者では癌、血栓、死亡のリスクが高かった。
• mRNAワクチン(コミナティ、スパイクバックス)と月経障害
―前回のレビューで因果関係を支持しないと結論したが、文献および自発報告
を考慮し再度評価した。因果関係はまだ明らかではない。
• COVID-19ワクチンのリスク管理計画(RMP)に関するガイダンスを
改訂
• 妊娠中または授乳中にインフリキシマブに曝露された乳児への
生ワクチンの使用を延期するよう助言
―インフリキシマブは胎盤を通過し、母乳中にも低レベルで検出される。
17
米国の市販後安全対策担当部局
保健福祉省(HHS)
Department of Health and Human Services
監察総監室(OIG)
食品医薬品庁(FDA)
Office of Inspector General
Food and Drug Administration
独立かつ客観的な監督機関。これまでに、
FDAに対してさまざまな調査・評価を行い、
OIGレポートを発行している。
例)『FDAには、リスク評価・軽減対策(REMS)が医薬
品安全性を向上させているか判断するための包括
的なデータが不足している』 (Report OEI-04-11-0051
02-12-2013)
Center for Drug Evaluation & Research
生物製品評価研究センター
(CBER)
医療機器・放射線保健
センター(CDRH)
Center for Biologics Evaluation & Research
Center for Device & Radiological Health
監視・疫学部(OSE)
生物統計・疫学部(OBE)
製品評価・品質部(OPEQ)
Office of Surveillance & Epidemiology
Office of Biostatistics & Epidemiology
Office of Product Evaluation & Quality
医薬品評価研究センター(CDER)
シグナル検出、評価等の担当
10
18