よむ、つかう、まなぶ。
【資料1-1】 医薬品等行政評価・監視委員会における海外調査の状況 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
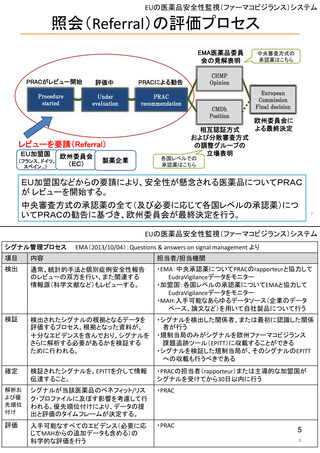
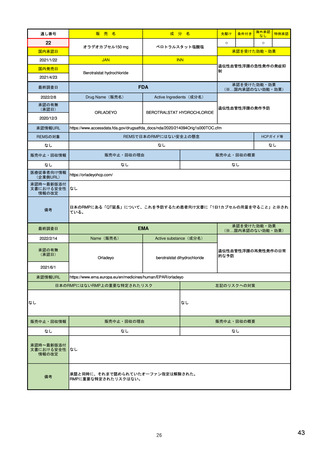
米国の医薬品安全性監視(ファーマコビジランス)システム
米国の製造販売後安全性監視指針
• Guidance for Industry
Postmarketing Safety Reporting for Human Drug and Biological Products
Including Vaccines (DRAFT) 2001.3~ <ワクチンを含む医薬品・バイオ
医薬品の市販後安全性報告について>
– 報告義務者:製造業者、販売業者(ライセンス契約に基づく製造・販売者も含む、
医薬品又は生物学的製剤の添付文書に名前の記載のある業者)
– 報告事項:個別症例安全性報告に記載するデータエレメント
– 報告のタイプ:15日報告(未知重篤有害事象)、小児の報告、フォローアップ報告
– 特殊な状況での報告:科学文献からの報告、市販後臨床試験/調査研究、
外国からの報告、死亡報告、過量投与の報告、有効性欠如の報告、
インターネット上の情報、小児患者、適応外使用、他
–
–
–
–
–
–
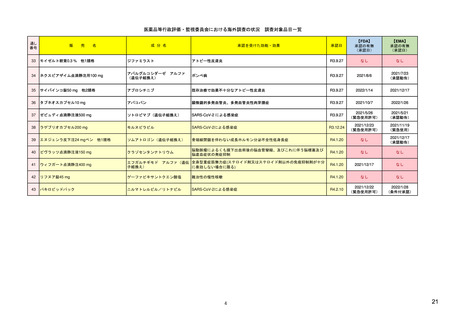
個別症例安全性報告における有害事象のコード化
報告様式:FDA 3500A 他
市販後安全性報告の提出方法・提出先
市販後安全性報告に関する手順書
市販後安全性報告の免除に関する要望書
有害事象コンピュータシステムの妥当性検証
11
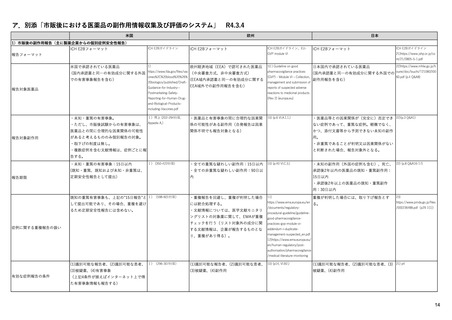
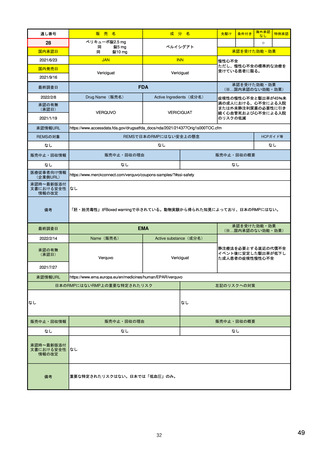
米国の医薬品安全性監視(ファーマコビジランス)システム
米国の製造販売後安全性監視指針
• Guidance for Industry
Good Pharmacovigilance Practices and Pharmacoepidemiologic Assessment
(FINAL) 2005.3~ <医薬品安全性監視と薬剤疫学的評価の方法>
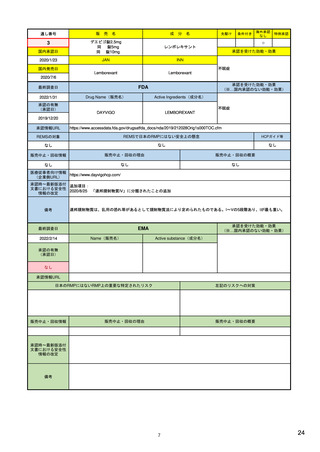
– 医薬品リスク管理における安全性監視と薬剤疫学の役割
– 安全性シグナルの検出方法及び記述方法
– 症例レビュー以上の検討:観察研究によるシグナルの調査(薬剤疫学研究、
患者登録、患者または医療従事者を対象とした調査による情報収集)
– 安全性シグナルの解釈:安全性シグナルから安全性検討事項へ格上げ
– 通常の医薬品安全性監視を超えた活動:医薬品安全性監視計画の策定
• Best Practices in Drug and Biological Product Postmarket Safety Surveillance for
FDA Staff (DRAFT) 2019.11~ <FDAにおける市販後安全性監視方法>
– FDAにおける医薬品安全性監視方法の概要:リスクベースアプローチの重要性
– 安全性シグナルの特定:データソース、スクリーニング範囲・方法・頻度、シグナルの優先順位付け
– シグナルの評価と記録:FAERS等での症例検索→症例定義→因果関係評価→ケースシリーズ作
成。他に、使用実態、報告割合、疫学的評価も行う。
– 製品と有害事象の因果関係評価:データ全体からのエビデンスの強さに基づき判断
– 規制措置:方法として、添付文書改訂、安全性通知(Drug Safety Communication)、市販後研究・臨
床試験、安全性監視強化、潜在的な安全性シグナルのWeb掲載、リスク評価・リスク緩和戦略
7
12
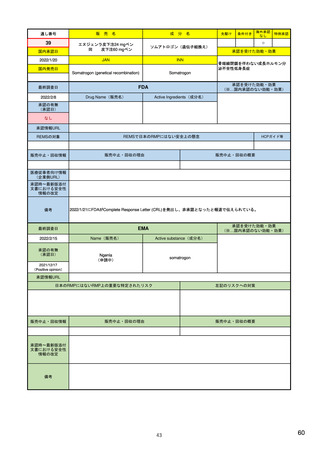
米国の製造販売後安全性監視指針
• Guidance for Industry
Postmarketing Safety Reporting for Human Drug and Biological Products
Including Vaccines (DRAFT) 2001.3~ <ワクチンを含む医薬品・バイオ
医薬品の市販後安全性報告について>
– 報告義務者:製造業者、販売業者(ライセンス契約に基づく製造・販売者も含む、
医薬品又は生物学的製剤の添付文書に名前の記載のある業者)
– 報告事項:個別症例安全性報告に記載するデータエレメント
– 報告のタイプ:15日報告(未知重篤有害事象)、小児の報告、フォローアップ報告
– 特殊な状況での報告:科学文献からの報告、市販後臨床試験/調査研究、
外国からの報告、死亡報告、過量投与の報告、有効性欠如の報告、
インターネット上の情報、小児患者、適応外使用、他
–
–
–
–
–
–
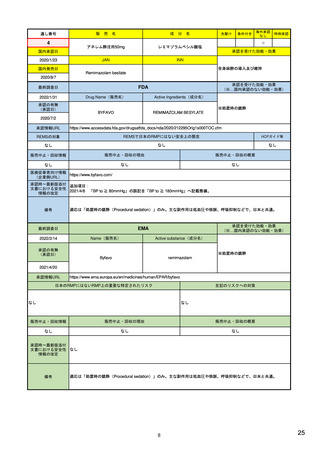
個別症例安全性報告における有害事象のコード化
報告様式:FDA 3500A 他
市販後安全性報告の提出方法・提出先
市販後安全性報告に関する手順書
市販後安全性報告の免除に関する要望書
有害事象コンピュータシステムの妥当性検証
11
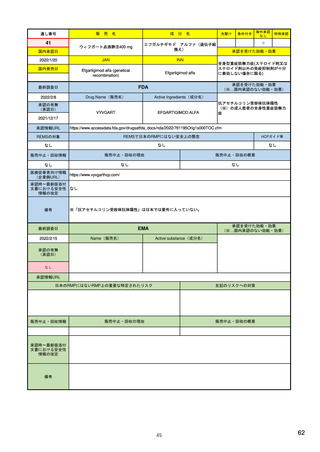
米国の医薬品安全性監視(ファーマコビジランス)システム
米国の製造販売後安全性監視指針
• Guidance for Industry
Good Pharmacovigilance Practices and Pharmacoepidemiologic Assessment
(FINAL) 2005.3~ <医薬品安全性監視と薬剤疫学的評価の方法>
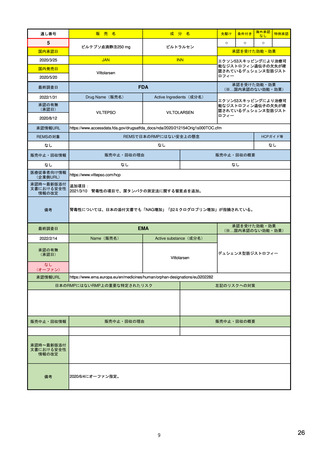
– 医薬品リスク管理における安全性監視と薬剤疫学の役割
– 安全性シグナルの検出方法及び記述方法
– 症例レビュー以上の検討:観察研究によるシグナルの調査(薬剤疫学研究、
患者登録、患者または医療従事者を対象とした調査による情報収集)
– 安全性シグナルの解釈:安全性シグナルから安全性検討事項へ格上げ
– 通常の医薬品安全性監視を超えた活動:医薬品安全性監視計画の策定
• Best Practices in Drug and Biological Product Postmarket Safety Surveillance for
FDA Staff (DRAFT) 2019.11~ <FDAにおける市販後安全性監視方法>
– FDAにおける医薬品安全性監視方法の概要:リスクベースアプローチの重要性
– 安全性シグナルの特定:データソース、スクリーニング範囲・方法・頻度、シグナルの優先順位付け
– シグナルの評価と記録:FAERS等での症例検索→症例定義→因果関係評価→ケースシリーズ作
成。他に、使用実態、報告割合、疫学的評価も行う。
– 製品と有害事象の因果関係評価:データ全体からのエビデンスの強さに基づき判断
– 規制措置:方法として、添付文書改訂、安全性通知(Drug Safety Communication)、市販後研究・臨
床試験、安全性監視強化、潜在的な安全性シグナルのWeb掲載、リスク評価・リスク緩和戦略
7
12