よむ、つかう、まなぶ。
【資料1-1】 医薬品等行政評価・監視委員会における海外調査の状況 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
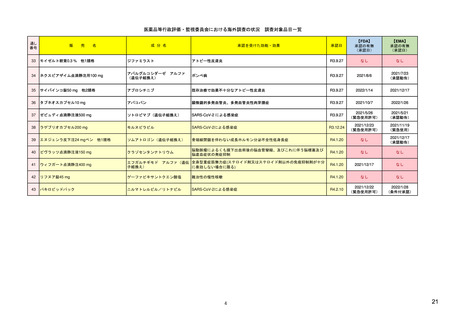
1. 市販後における医薬品の副作用情報収集およ
ア
び評価のシステム
日米欧における副作用情報の報告対象
範囲の比較表
※別添Excelファイル参照
3
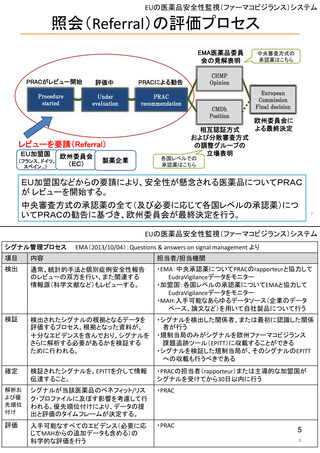
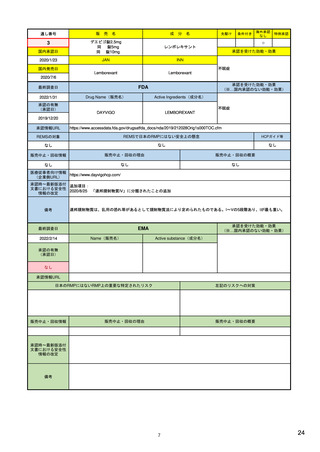
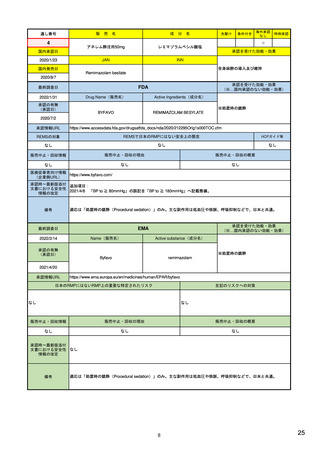
EUの医薬品安全性監視(ファーマコビジランス)システム
新医薬品安全性監視法(EU新PV法)
• 新たな科学委員会である医薬品安全性監視・リスク評価委員会
(Pharmacovigilance Risk Assessment Committee:PRAC)を創設
• 欧州での医薬品の安全性・有効性モニタリングに関与する全関係者の
役割と責任を明確化し、協調を強めることにより、EUの意思決定を強
化・迅速化する。
• 患者および医療従事者が規制プロセスに参画する
例)医薬品との関連が疑われる有害事象を消費者(患者)が直接報告。
• 医薬品に関する主要な情報の収集を強化する。
例)リスクに応じて課せられる承認後安全性・有効性研究を通じた
収集
• 透明性および情報伝達を向上させる。
例)PRACの議事予定や議事録の公開、および公聴会の開催
<2012年7月2日付 EMA Press releaseより>
3
4
ア
び評価のシステム
日米欧における副作用情報の報告対象
範囲の比較表
※別添Excelファイル参照
3
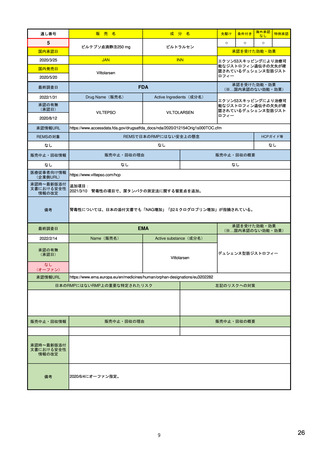
EUの医薬品安全性監視(ファーマコビジランス)システム
新医薬品安全性監視法(EU新PV法)
• 新たな科学委員会である医薬品安全性監視・リスク評価委員会
(Pharmacovigilance Risk Assessment Committee:PRAC)を創設
• 欧州での医薬品の安全性・有効性モニタリングに関与する全関係者の
役割と責任を明確化し、協調を強めることにより、EUの意思決定を強
化・迅速化する。
• 患者および医療従事者が規制プロセスに参画する
例)医薬品との関連が疑われる有害事象を消費者(患者)が直接報告。
• 医薬品に関する主要な情報の収集を強化する。
例)リスクに応じて課せられる承認後安全性・有効性研究を通じた
収集
• 透明性および情報伝達を向上させる。
例)PRACの議事予定や議事録の公開、および公聴会の開催
<2012年7月2日付 EMA Press releaseより>
3
4