よむ、つかう、まなぶ。
【資料1-1】 医薬品等行政評価・監視委員会における海外調査の状況 (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
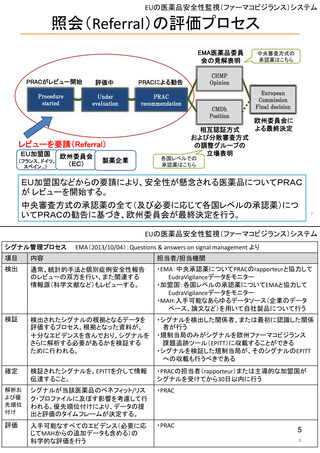
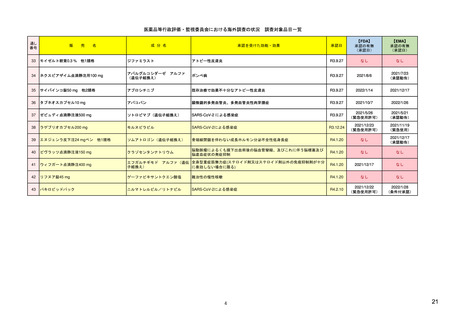
ア.別添「市販後における医薬品の副作用情報収集及び評価のシステム」
R4.3.4
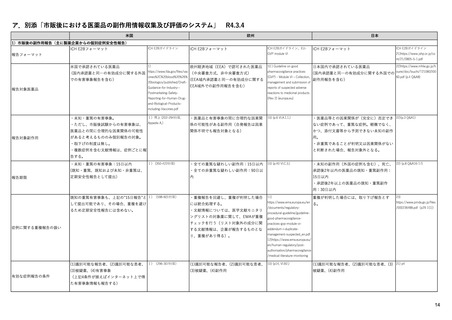
米国
シグナル検出(detection)
欧州
日本
FAERSを用いたデータマイニング手法(不
7)
EudraVigilanceを活用し、中央承認薬につい MAH、規制当局
・JADERを用いた解析、文献、外国規制当局か 27) 及び 28)
均衡解析)によるシグナル検出(受動的監
https://www.fda.gov/media/1
てはEMA、各国承認薬については各国規制
らの情報をもとにシグナル検出を実施。死亡・ https://www.pmda.go.jp/sa
当局が担当する(製薬企業も関与する)。
未知重篤等の15日報告に相当する場合は、原則
視)。
37475/download
fety/surveillanceanalysis/0049.html
として翌執務日中に因果関係等の評価を行う。
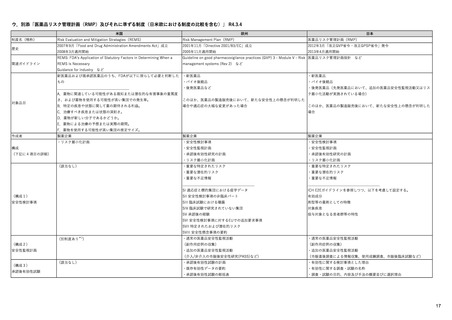
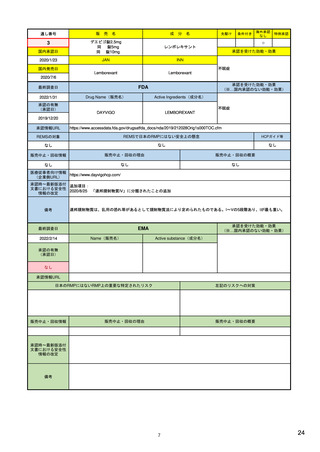
シグナル検証
得られた安全性シグナルについて、より大規 7)(Table 1)
EMAがバリデーションを主導し、PRACは、 (検証)EMA、各国規制当局
模な患者集団でのリスク評価のため、セン
検証シグナルの受け取り後30日以内にシグナ (確認)PRAC rapporteurまた れたシグナルについて、関連情報(添文の記載 28)
チネルシステム(全米規模の医療情報データ
ル確認を実施し、さらなる評価の必要性の
ネットワーク)を利用した評価を行う(積
検討、優先順位付けを行う。
は(主導)加盟国
(分析~)PRAC
の必要性を検討。
7) (8ページ)
し、規制措置の必要性を決定して、潜在的リ
シグナル評価
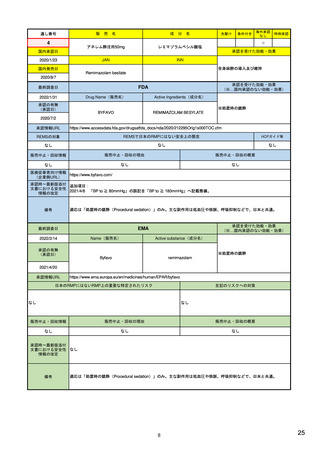
状況、医療情報データベースを用いた解析結果
等)を踏まえ、さらなる分析(シグナル評価)
極的監視)。
全ての入手データをもとに因果関係を評価
原則として週1回、1次スクリーニングで検出さ 27)
全ての入手データをもとに因果関係を評価
18)
全ての入手データをもとに因果関係を評価し、 27)
し、規制措置の必要性を決定し、特定され
https://www.ema.europa.eu/en
当該リスクの重要性や、特定されたリスクまた
スク、重要な潜在的リスク、緊急性のある
たリスクか、潜在的リスクか、さらに重要
リスクかを判断。
なリスクかを判断。
/documents/scientificguideline/guideline-good-
は潜在的なリスクかを判断。
pharmacovigilance-practicesgvp-module-ix-signalmanagement-rev-1_en.pdf
・FDAが必要と判断した場合、規制措置を
8)
PRACが安全確保のための規制措置を勧告
19) Q&A on signal management
PMDAが、専門協議の結果、必要と判断した場 27)
実施。
https://www.fda.gov/media/7
し、ヒト用医薬品委員会(CHMP)にて採
(europa.eu) (p.5, section 7)
合、厚労省により安全対策措置が実施。
・医薬品評価研究センター各部から重要な
規制措置の実施
1622/download(4ページ)
択された場合、各国規制当局にて実施
新規の安全性事案が出された場合、医薬品
安全性監視委員会が、その取り扱いと周知
方法について議論し、医薬品評価研究セン
ター長に助言。
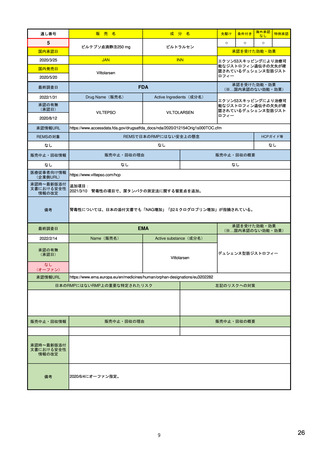
特定された安全性シグナルの公表
四半期に1度、FAERSで特定された重要なシ 9) Potential Signals of Serious 毎月、PRACでのシグナルに関する討議の結 20) PRAC recommendations on 適時、評価中のシグナルをウェブ上に公開。
29) 医薬品に関する評価中の
グナルや新たな安全性情報をウエブ上で公開 Risks/New Safety Information 果、採択された勧告の概要をウェブ上で公
safety signals
リスク等の情報について
https://www.ema.europa.eu/en
https://www.pmda.go.jp/safet
/human-regulatory/post-
y/info-services/drugs/calling-
authorisation/pharmacovigilance
attention/risk-
/signal-management/prac-
communications/0001.html
・規制措置(添付文書改訂の要求、REMS作
成の要求、追加データ収集の要求など)が
取られた場合、その旨記載。
Identified from the FDA
Adverse Event Reporting
System (FAERS) | FDA
開
recommendations-safety-signals
*
製薬企業はEEA内で承認されている自社の医薬品の個別症例安全性報告データセットにアクセス可。EEA内の各国規制当局はすべてのデータにアクセス可。
アカデミアは調査請求を提出することにより自発報告の拡張データセットを利用可能。WHO-ウプサラモニタリングセンターには、自発報告と非介入試験の報告が提供される。
EU外の規制機関は、請求により(安全性問題評価のため、など)WHO-ウプサラモニタリングセンターが利用可能なデータセットの提供を受けることができる。
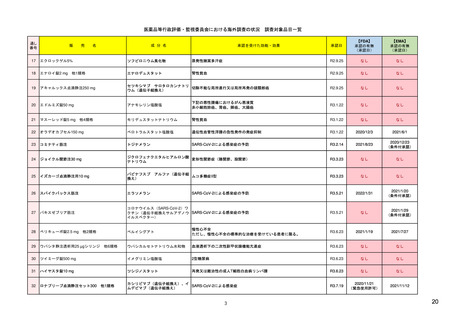
16
R4.3.4
米国
シグナル検出(detection)
欧州
日本
FAERSを用いたデータマイニング手法(不
7)
EudraVigilanceを活用し、中央承認薬につい MAH、規制当局
・JADERを用いた解析、文献、外国規制当局か 27) 及び 28)
均衡解析)によるシグナル検出(受動的監
https://www.fda.gov/media/1
てはEMA、各国承認薬については各国規制
らの情報をもとにシグナル検出を実施。死亡・ https://www.pmda.go.jp/sa
当局が担当する(製薬企業も関与する)。
未知重篤等の15日報告に相当する場合は、原則
視)。
37475/download
fety/surveillanceanalysis/0049.html
として翌執務日中に因果関係等の評価を行う。
シグナル検証
得られた安全性シグナルについて、より大規 7)(Table 1)
EMAがバリデーションを主導し、PRACは、 (検証)EMA、各国規制当局
模な患者集団でのリスク評価のため、セン
検証シグナルの受け取り後30日以内にシグナ (確認)PRAC rapporteurまた れたシグナルについて、関連情報(添文の記載 28)
チネルシステム(全米規模の医療情報データ
ル確認を実施し、さらなる評価の必要性の
ネットワーク)を利用した評価を行う(積
検討、優先順位付けを行う。
は(主導)加盟国
(分析~)PRAC
の必要性を検討。
7) (8ページ)
し、規制措置の必要性を決定して、潜在的リ
シグナル評価
状況、医療情報データベースを用いた解析結果
等)を踏まえ、さらなる分析(シグナル評価)
極的監視)。
全ての入手データをもとに因果関係を評価
原則として週1回、1次スクリーニングで検出さ 27)
全ての入手データをもとに因果関係を評価
18)
全ての入手データをもとに因果関係を評価し、 27)
し、規制措置の必要性を決定し、特定され
https://www.ema.europa.eu/en
当該リスクの重要性や、特定されたリスクまた
スク、重要な潜在的リスク、緊急性のある
たリスクか、潜在的リスクか、さらに重要
リスクかを判断。
なリスクかを判断。
/documents/scientificguideline/guideline-good-
は潜在的なリスクかを判断。
pharmacovigilance-practicesgvp-module-ix-signalmanagement-rev-1_en.pdf
・FDAが必要と判断した場合、規制措置を
8)
PRACが安全確保のための規制措置を勧告
19) Q&A on signal management
PMDAが、専門協議の結果、必要と判断した場 27)
実施。
https://www.fda.gov/media/7
し、ヒト用医薬品委員会(CHMP)にて採
(europa.eu) (p.5, section 7)
合、厚労省により安全対策措置が実施。
・医薬品評価研究センター各部から重要な
規制措置の実施
1622/download(4ページ)
択された場合、各国規制当局にて実施
新規の安全性事案が出された場合、医薬品
安全性監視委員会が、その取り扱いと周知
方法について議論し、医薬品評価研究セン
ター長に助言。
特定された安全性シグナルの公表
四半期に1度、FAERSで特定された重要なシ 9) Potential Signals of Serious 毎月、PRACでのシグナルに関する討議の結 20) PRAC recommendations on 適時、評価中のシグナルをウェブ上に公開。
29) 医薬品に関する評価中の
グナルや新たな安全性情報をウエブ上で公開 Risks/New Safety Information 果、採択された勧告の概要をウェブ上で公
safety signals
リスク等の情報について
https://www.ema.europa.eu/en
https://www.pmda.go.jp/safet
/human-regulatory/post-
y/info-services/drugs/calling-
authorisation/pharmacovigilance
attention/risk-
/signal-management/prac-
communications/0001.html
・規制措置(添付文書改訂の要求、REMS作
成の要求、追加データ収集の要求など)が
取られた場合、その旨記載。
Identified from the FDA
Adverse Event Reporting
System (FAERS) | FDA
開
recommendations-safety-signals
*
製薬企業はEEA内で承認されている自社の医薬品の個別症例安全性報告データセットにアクセス可。EEA内の各国規制当局はすべてのデータにアクセス可。
アカデミアは調査請求を提出することにより自発報告の拡張データセットを利用可能。WHO-ウプサラモニタリングセンターには、自発報告と非介入試験の報告が提供される。
EU外の規制機関は、請求により(安全性問題評価のため、など)WHO-ウプサラモニタリングセンターが利用可能なデータセットの提供を受けることができる。
16