よむ、つかう、まなぶ。
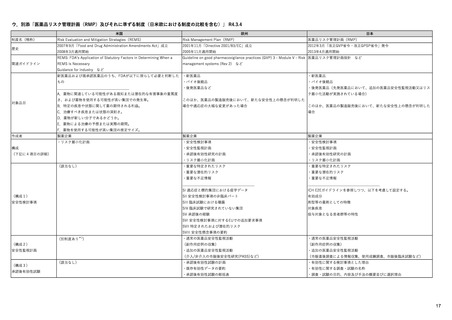
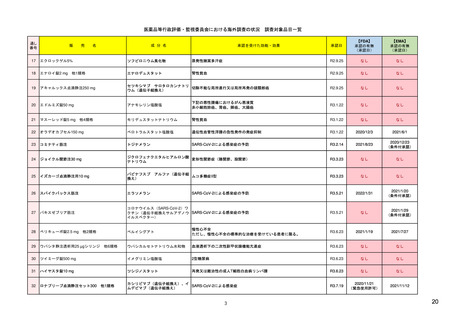
【資料1-1】 医薬品等行政評価・監視委員会における海外調査の状況 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
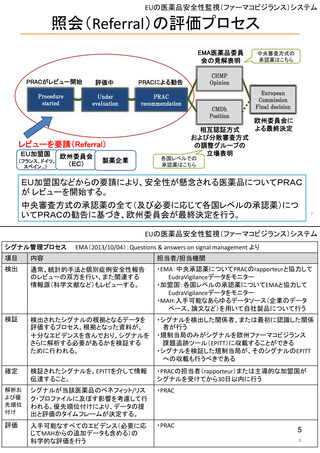
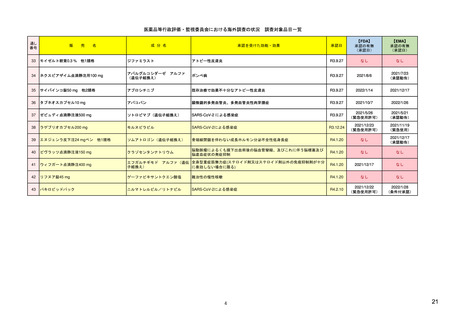
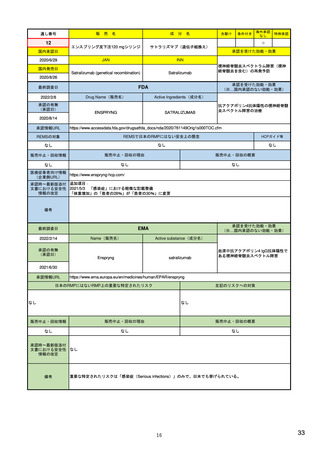
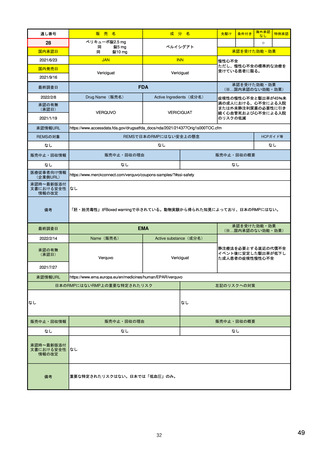
EUの医薬品安全性監視(ファーマコビジランス)システム
EUの医薬品安全性監視システム
X:追加のモ
ニタリング
VIII:PASS
V:医薬品リスク
管理システム
VI:副作用
症例
リスク最小化
活動の策定
VII:PSUR
V:医薬品リスク
管理システム
市販後
承認前
企業
IX:シグナル管理
PRAC
企業、EMA、各国規制当局
副作用
収集
シグナル
検出
エビデンス
評価
規制措置
査察、
監査、
改善、
規制措置
の有効性
を測定
PRAC
CHMP
情報伝達
(DHPCなど)
企業、EMA、各国規制当局
III:PV査察
:担当する機関
IV:PV監査
XVI:リスク
最小化策
XV:安全性
情報伝達
XVI:リスク
最小化策
:EU-GVP module
Promoting and Protecting Public Health: How the European Union Pharmacovigilance System Works.
Santoro A, Genov G, Spooner A, Raine J, Arlett P. Drug Saf. 2017 Oct;40(10):855-869.
5
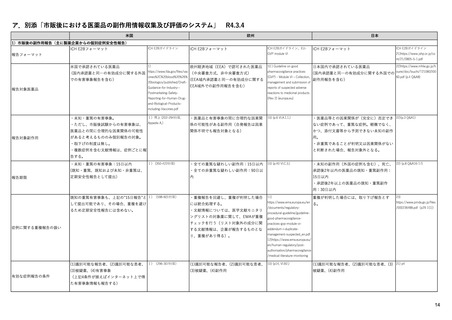
EUの医薬品安全性監視(ファーマコビジランス)システム
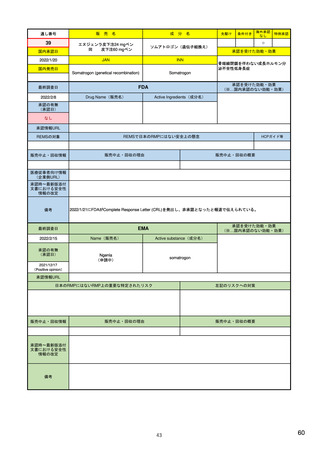
EUの製造販売後安全性監視指針
(Good Vigilance Practiceのモジュール)
• Module I: Pharmacovigilance Systems and their Quality Systems
(医薬品安全性監視システムとその品質システム)
• Module II: Pharmacovigilance System Master File
(医薬品安全性監視システムに関するマスターファイル)
• Module III: Pharmacovigilance inspections (医薬品安全性監視に関する査察)
• Module IV : Pharmacovigilance audits (医薬品安全性監視に関する監査)
• Module V: Risk Management Systems (リスク管理システム)
• Module VI:Collection, Management and Reporting of Adverse Reactions to Medicinal Products
(医薬品使用に伴う有害反応の収集、管理と報告)
• Module VII: Periodic Safety Update Report(PSUR) (定期的安全性最新報告)
• Module VIII: Post-Authorisation Safety Studies(PASS) (承認後の安全性研究)
• Module IX: Signal Management (安全性シグナルの管理)
• Module X: Additional monitoring (追加のモニタリング)
• Module XV : Safety communication (安全性に関するコミュニケーション)
• Module XVI : Risk minimisation measures: selection of tools and effectiveness indicators
(リスク最小化策:ツールの選択と有効性指標)
4
主要なモジュールを記載
6
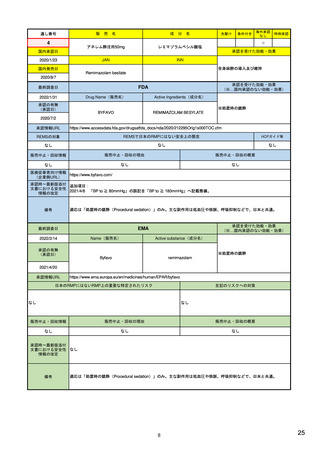
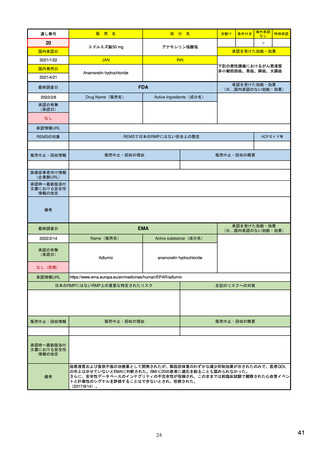
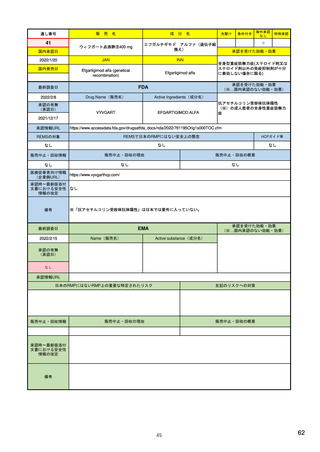
EUの医薬品安全性監視システム
X:追加のモ
ニタリング
VIII:PASS
V:医薬品リスク
管理システム
VI:副作用
症例
リスク最小化
活動の策定
VII:PSUR
V:医薬品リスク
管理システム
市販後
承認前
企業
IX:シグナル管理
PRAC
企業、EMA、各国規制当局
副作用
収集
シグナル
検出
エビデンス
評価
規制措置
査察、
監査、
改善、
規制措置
の有効性
を測定
PRAC
CHMP
情報伝達
(DHPCなど)
企業、EMA、各国規制当局
III:PV査察
:担当する機関
IV:PV監査
XVI:リスク
最小化策
XV:安全性
情報伝達
XVI:リスク
最小化策
:EU-GVP module
Promoting and Protecting Public Health: How the European Union Pharmacovigilance System Works.
Santoro A, Genov G, Spooner A, Raine J, Arlett P. Drug Saf. 2017 Oct;40(10):855-869.
5
EUの医薬品安全性監視(ファーマコビジランス)システム
EUの製造販売後安全性監視指針
(Good Vigilance Practiceのモジュール)
• Module I: Pharmacovigilance Systems and their Quality Systems
(医薬品安全性監視システムとその品質システム)
• Module II: Pharmacovigilance System Master File
(医薬品安全性監視システムに関するマスターファイル)
• Module III: Pharmacovigilance inspections (医薬品安全性監視に関する査察)
• Module IV : Pharmacovigilance audits (医薬品安全性監視に関する監査)
• Module V: Risk Management Systems (リスク管理システム)
• Module VI:Collection, Management and Reporting of Adverse Reactions to Medicinal Products
(医薬品使用に伴う有害反応の収集、管理と報告)
• Module VII: Periodic Safety Update Report(PSUR) (定期的安全性最新報告)
• Module VIII: Post-Authorisation Safety Studies(PASS) (承認後の安全性研究)
• Module IX: Signal Management (安全性シグナルの管理)
• Module X: Additional monitoring (追加のモニタリング)
• Module XV : Safety communication (安全性に関するコミュニケーション)
• Module XVI : Risk minimisation measures: selection of tools and effectiveness indicators
(リスク最小化策:ツールの選択と有効性指標)
4
主要なモジュールを記載
6