よむ、つかう、まなぶ。
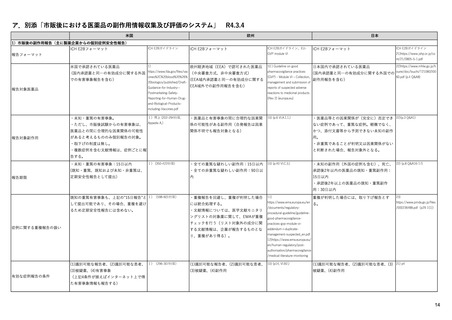
【資料1-1】 医薬品等行政評価・監視委員会における海外調査の状況 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
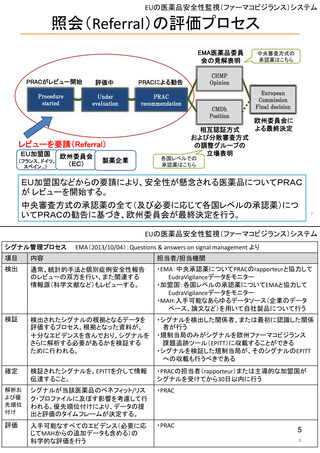
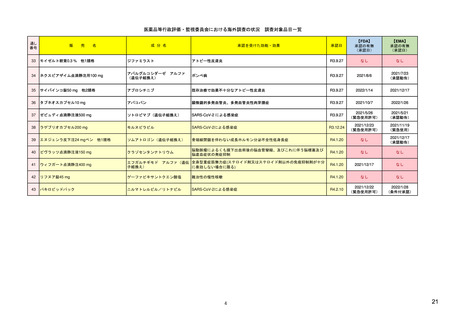
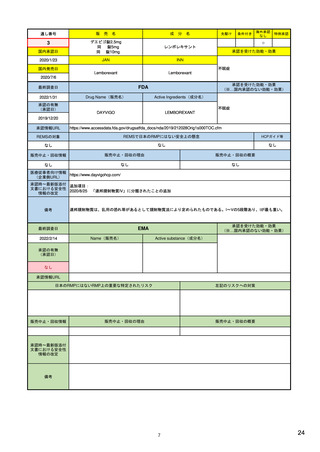
リスク管理計画
日本でのリスク管理計画: 医薬品の開発から市販後まで一貫したリスク管理を
一つの文書にまとめ、調査・試験やリスクを低減するための取り組みの
進捗に合わせて、又は定期的に確実に評価が行われるようにするもの。
個別の医薬品ごとに、企業が作成
(1)重要な関連性が明らか、又は疑われる副作用や不足情報(安全性検討事項)
(2)市販後に実施される情報収集活動(医薬品安全性監視活動)
(3)医療関係者への情報提供や使用条件の設定等の医薬品のリスクを低減する
ための取り組み(リスク最小化活動)
をまとめた文書。
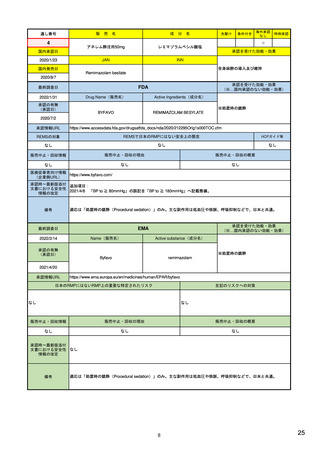
医薬品安全性監視活動とリスク最小化活動には、「通常」と「追加」の2種類あり
通常の活動: 全ての医薬品に共通して製造販売業者が実施する活動
副作用情報の収集、添付文書による情報提供など
追加の活動: 医薬品の特性を踏まえ個別に実施される活動
市販直後調査、使用成績調査、製造販売後臨床試験、
適正使用のための資材による情報提供など
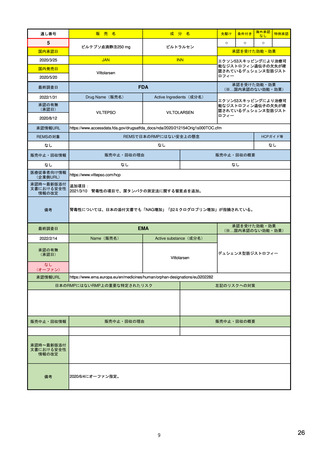
欧米での制度
欧州: 全医薬品が対象で、比較的日本と類似(見直し時期、評価内容等は異なる)
米国: FDAが必要と判断した場合に、安全性監視活動はPMR(市販後義務事項)や
PMC(市販後コミットメント調査)、リスク最小化活動はREMSとして作成 23
13
日本でのリスク管理計画: 医薬品の開発から市販後まで一貫したリスク管理を
一つの文書にまとめ、調査・試験やリスクを低減するための取り組みの
進捗に合わせて、又は定期的に確実に評価が行われるようにするもの。
個別の医薬品ごとに、企業が作成
(1)重要な関連性が明らか、又は疑われる副作用や不足情報(安全性検討事項)
(2)市販後に実施される情報収集活動(医薬品安全性監視活動)
(3)医療関係者への情報提供や使用条件の設定等の医薬品のリスクを低減する
ための取り組み(リスク最小化活動)
をまとめた文書。
医薬品安全性監視活動とリスク最小化活動には、「通常」と「追加」の2種類あり
通常の活動: 全ての医薬品に共通して製造販売業者が実施する活動
副作用情報の収集、添付文書による情報提供など
追加の活動: 医薬品の特性を踏まえ個別に実施される活動
市販直後調査、使用成績調査、製造販売後臨床試験、
適正使用のための資材による情報提供など
欧米での制度
欧州: 全医薬品が対象で、比較的日本と類似(見直し時期、評価内容等は異なる)
米国: FDAが必要と判断した場合に、安全性監視活動はPMR(市販後義務事項)や
PMC(市販後コミットメント調査)、リスク最小化活動はREMSとして作成 23
13