よむ、つかう、まなぶ。
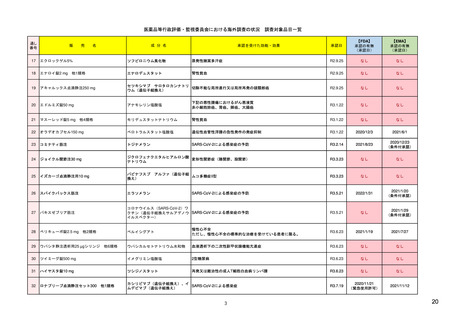
【資料1-1】 医薬品等行政評価・監視委員会における海外調査の状況 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
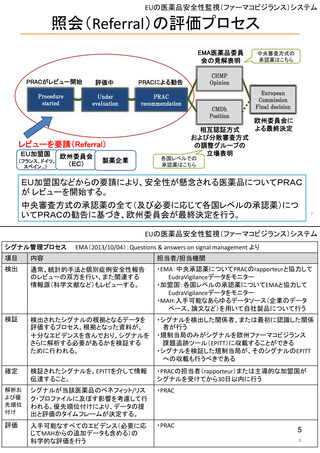
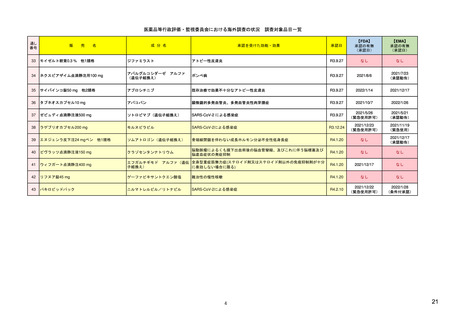
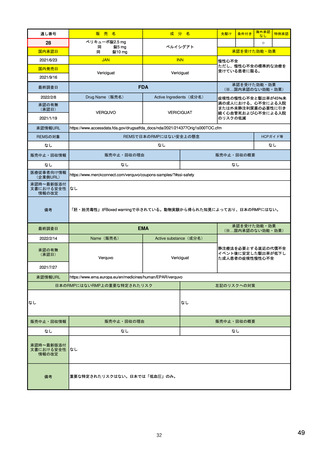
EUの市販後安全対策担当部局
医薬品安全性監視・リスク評価委員会
PRAC
ヒト用医薬品の安全性の評価・
モニタリングを担う
毎月会議を開催
安全性問題について検討し、規制措置(製品情報改訂など)を勧告
CAPを含まない場合(各国承認薬NAPなど)
中央承認薬(CAP)を含む場合
相互認証方式及び分散審査方式の調整グループ
ヒト用医薬品委員会
CMDh
CHMP
相互認証方式または分散審査方式の手続きに従って、
複数の加盟国でヒト用医薬品の販売許可に関する問題
の審査と調整役を務める
製品情報改訂のための変更(variation)を評価
欧州委員会
European Commission
EU全域で拘束力のある決定を行う
中央承認薬: EUとして承認した医薬品
15
PRACとは
PRAC: 医薬品安全性監視・リスク評価委員会
• PRACは、ヒト用医薬品のリスク管理をあらゆる面から評価す
ることを責務とする。医薬品の治療効果も考慮しつつ、有害
反応のリスクの検出、評価、最小化、および情報伝達などを
行う。市販後安全性研究のデザインおよび評価と、医薬品安
全性監視の査察も担当する。
• PRACの主な責務は、ヒト用医薬品の安全性監視活動に関わ
る問題についての勧告と、リスク管理システムに関する勧告
を作成することであり、リスク管理システムの有効性のモニタ
リングも含む。
• PRACの勧告は、通常、CHMP(医薬品委員会)、CMDh(相互
認証方式および分散審査方式の調整グループ)、EMA事務
局(European Medicines Agency secretariat)、管理委員会
(Management Board)、および欧州委員会(EC)などへ適宜送
られる。
9
16
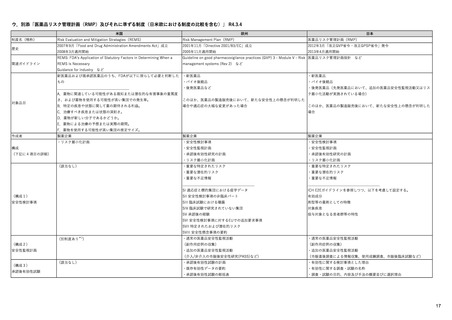
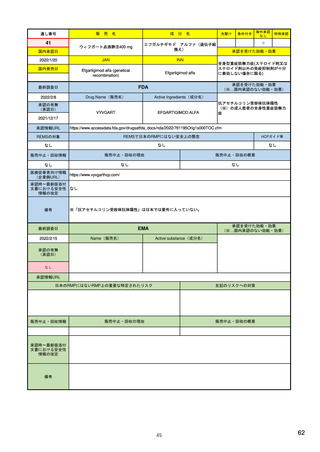
医薬品安全性監視・リスク評価委員会
PRAC
ヒト用医薬品の安全性の評価・
モニタリングを担う
毎月会議を開催
安全性問題について検討し、規制措置(製品情報改訂など)を勧告
CAPを含まない場合(各国承認薬NAPなど)
中央承認薬(CAP)を含む場合
相互認証方式及び分散審査方式の調整グループ
ヒト用医薬品委員会
CMDh
CHMP
相互認証方式または分散審査方式の手続きに従って、
複数の加盟国でヒト用医薬品の販売許可に関する問題
の審査と調整役を務める
製品情報改訂のための変更(variation)を評価
欧州委員会
European Commission
EU全域で拘束力のある決定を行う
中央承認薬: EUとして承認した医薬品
15
PRACとは
PRAC: 医薬品安全性監視・リスク評価委員会
• PRACは、ヒト用医薬品のリスク管理をあらゆる面から評価す
ることを責務とする。医薬品の治療効果も考慮しつつ、有害
反応のリスクの検出、評価、最小化、および情報伝達などを
行う。市販後安全性研究のデザインおよび評価と、医薬品安
全性監視の査察も担当する。
• PRACの主な責務は、ヒト用医薬品の安全性監視活動に関わ
る問題についての勧告と、リスク管理システムに関する勧告
を作成することであり、リスク管理システムの有効性のモニタ
リングも含む。
• PRACの勧告は、通常、CHMP(医薬品委員会)、CMDh(相互
認証方式および分散審査方式の調整グループ)、EMA事務
局(European Medicines Agency secretariat)、管理委員会
(Management Board)、および欧州委員会(EC)などへ適宜送
られる。
9
16