よむ、つかう、まなぶ。
【資料1-1】 医薬品等行政評価・監視委員会における海外調査の状況 (12 ページ)
出典
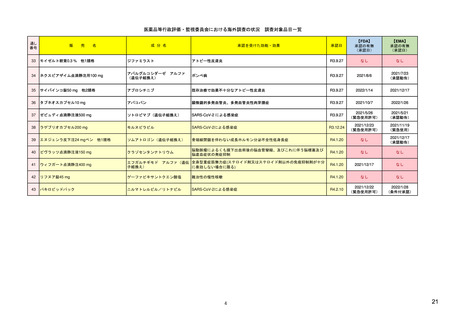
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
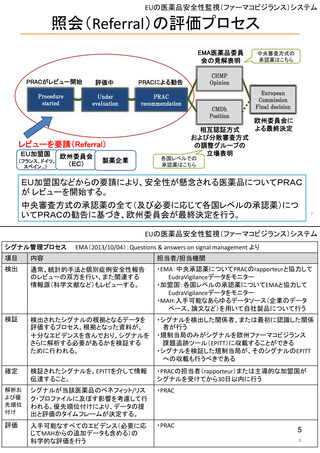
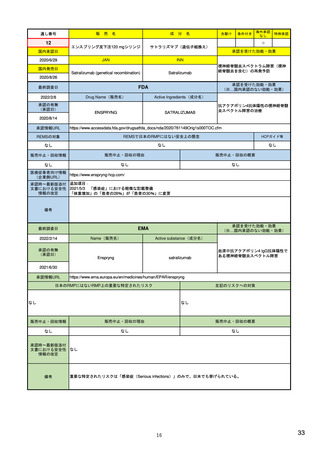
Drug Safety Oversight Board(医薬品安全性監視委員会)
創設: 2005年(2007年のFDA改正法で法的に設置付け)
構成: FDA: 医薬品評価研究センター(CDER): 監視・疫学部、新薬審査部、生
物統計部、臨床薬理部、コミュニケーション部等 9部
生物製品評価研究センター(CBER)
医療機器・放射線保健センター
7つの連邦政府機関の代表者
医療研究・品質保証機構(AHRQ)、疾病対策予防センター(CDC)、
メディケア・メディケイド・サービスセンター(CMS)、国防総省(DOD)、
刑務所局(BOP)、先住民族保健サービス(IHS)、退役軍人省(VA)
頻度: 随時開催(年に1-3回程度)
業務: 重要な新規の医薬品安全性事案に関し、その取り扱いと周知方法について、
CDER・センター長に助言(主に下記を議論)
- 医薬品の安全性やリスク管理に関する問題のうち、新規発生事案・進行事案
- 医療従事者、患者、一般住民への医薬品の安全性情報の効果的な伝達方法(CDER・
コミュニケーション部からの諮問による)
- 医薬品の安全性に関する一般方針と、内部方針の相違の解消の実現に向けた取組
- 内部で意見の相違がある医薬品の安全性に関する問題
- REMSに関する製造販売業者とCDERとの間の意見の相違
21
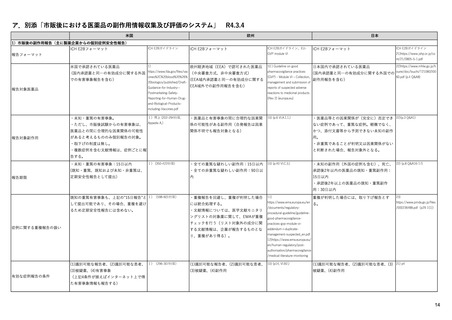
1. 医薬品リスク管理計画(RMP)及びそれに
ウ
準ずる制度
日米欧における制度の比較を含む
※別添Excelファイル参照
12
22
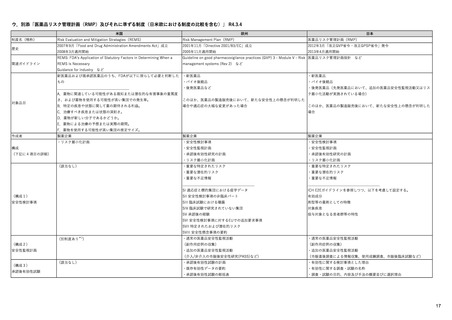
創設: 2005年(2007年のFDA改正法で法的に設置付け)
構成: FDA: 医薬品評価研究センター(CDER): 監視・疫学部、新薬審査部、生
物統計部、臨床薬理部、コミュニケーション部等 9部
生物製品評価研究センター(CBER)
医療機器・放射線保健センター
7つの連邦政府機関の代表者
医療研究・品質保証機構(AHRQ)、疾病対策予防センター(CDC)、
メディケア・メディケイド・サービスセンター(CMS)、国防総省(DOD)、
刑務所局(BOP)、先住民族保健サービス(IHS)、退役軍人省(VA)
頻度: 随時開催(年に1-3回程度)
業務: 重要な新規の医薬品安全性事案に関し、その取り扱いと周知方法について、
CDER・センター長に助言(主に下記を議論)
- 医薬品の安全性やリスク管理に関する問題のうち、新規発生事案・進行事案
- 医療従事者、患者、一般住民への医薬品の安全性情報の効果的な伝達方法(CDER・
コミュニケーション部からの諮問による)
- 医薬品の安全性に関する一般方針と、内部方針の相違の解消の実現に向けた取組
- 内部で意見の相違がある医薬品の安全性に関する問題
- REMSに関する製造販売業者とCDERとの間の意見の相違
21
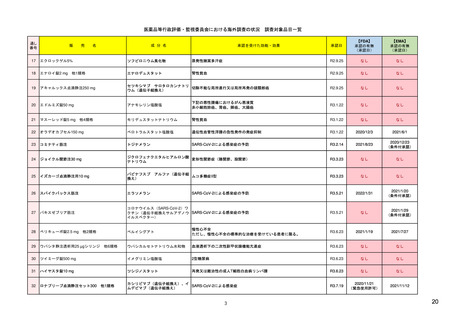
1. 医薬品リスク管理計画(RMP)及びそれに
ウ
準ずる制度
日米欧における制度の比較を含む
※別添Excelファイル参照
12
22