よむ、つかう、まなぶ。
【資料1-1】 医薬品等行政評価・監視委員会における海外調査の状況 (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
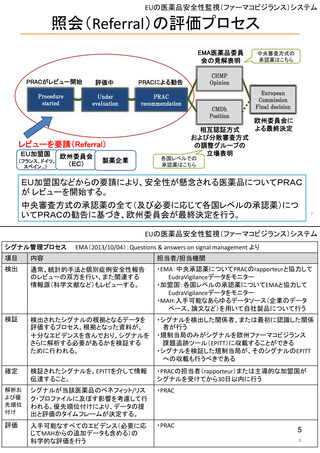
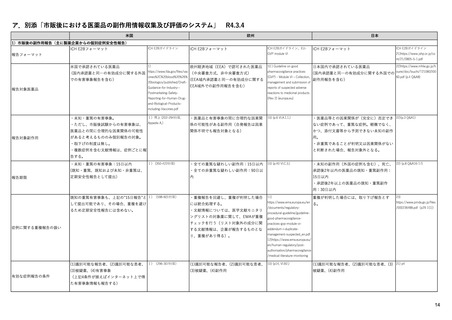
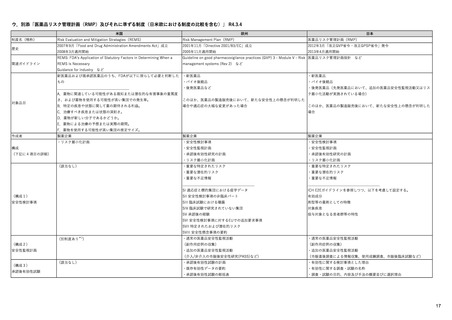
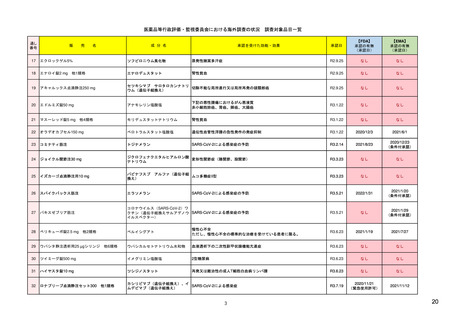
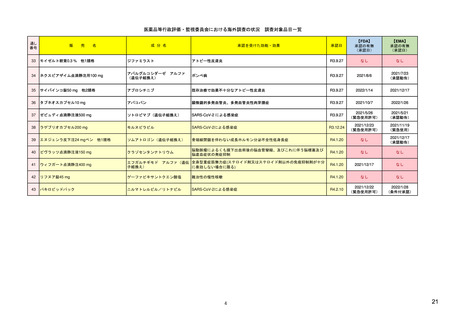
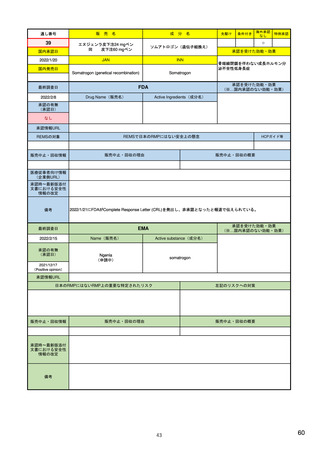
ウ.別添「医薬品リスク管理計画(RMP)及びそれに準ずる制度(日米欧における制度の比較を含む)」 R4.3.4
米国
(構成4)
リスク最小化計画
欧州
日本
・メディケーションガイドまたは患者向添付文書(PPI)の作成及び提供
・通常のリスク最小化活動
・通常のリスク最小化活動
(平易な表現による患者の理解促進、安全性注意喚起)
(添付文書(SmPC)・患者向医薬品ガイド(PIL)の作成及び提供)
(添付文書・患者向医薬品ガイドの作成及び提供)
・コミュニケーションプランの策定及び実施
・追加のリスク最小化活動
・追加のリスク最小化活動
(医療従事者向けの理解促進、安全性注意喚起資材配布など)
(教育プログラム、アクセス制御プログラム、流通管理システム、妊娠予防
(市販直後調査による情報提供、適正使用のための資材配布、使用条件の設
・患者アクセス管理システムETASU (Elements to Assure Safe Use)の策定
(回避)プログラム、医療従事者への直接情報伝達(DHPC)など)
定、医療従事者への追加の情報提供、患者への情報提供、表示・容器等の工
及び実装
夫など)
(施術者の訓練、患者レジストリ登録、医療実施施設の認証など)
____________________
・REMS計画の効果に関する評価
追加の措置の必要性を検討するにあたって考慮する点の例
(評価計画、評価分類、評価指標、評価データソース、有効性の閾値設定な
○推定使用患者数 ○投与状況 ○特定されているリスク集団 ○対象疾患の重
ど)
篤性、合併症の重篤性及び背景発現率 ○副作用がベネフィット・リスクバラ
ンス又は保健衛生の状況に対して及ぼす影響の大きさ ○重篤な副作用の重症
度、頻度、可逆性及び予防可能性 ○リスク最小化活動の実施により期待され
る効果 ○海外での開発又は製造販売の状況 ○海外との安全性プロファイル
の相違 ○海外で実施されている調査・試験の状況及び結果 ○海外で執られ
た安全対策
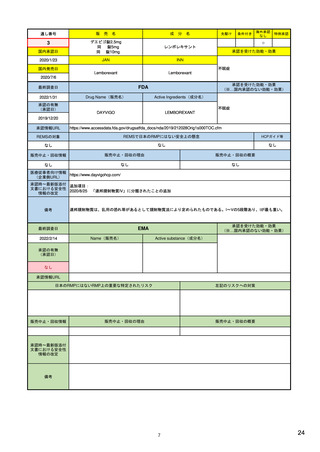
評価方法
見直し
・プロセス評価
・アウトカム評価
・アウトカム評価
・承認から少なくとも1.5, 3, 7年後に評価した結果により、変更または削除
・初回承認から5年後(販売承認更新時)
・再審査申請時
・5年更新後から最初の定期的安全性最新報告(PSUR)を提出する時
・計画書に明記された各活動の節目となる時期
https://www.fda.gov/regulatory-information/selected-amendments-fdc-
https://eur-
https://www.pmda.go.jp/files/000145482.pdf
act/food-and-drug-administration-amendments-act-fdaaa-2007
lex.europa.eu/LexUriServ/LexUriServ.do?uri=CONSLEG:2001L0083:20110 https://www.pmda.go.jp/files/000143723.pdf
https://www.fda.gov/media/100307/download
721:EN:PDF
https://www.pmda.go.jp/files/000145421.pdf
https://www.fda.gov/media/119790/download
https://www.ema.europa.eu/en/documents/scientific-
https://www.pmda.go.jp/files/000221117.pdf
https://www.fda.gov/media/136317/download
guideline/guideline-good-pharmacovigilance-practices-module-v-risk-
(更新は随時)
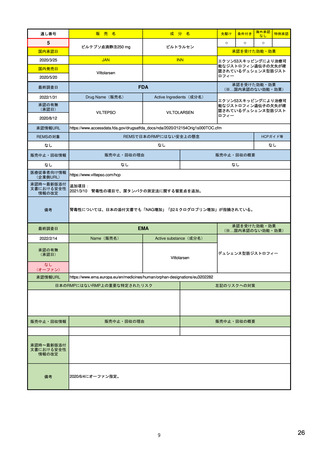
備考
出典
医薬品、副作用の特性に応じ、可能な範囲の評価方法で評価*2
・プロセス評価
COVID-19による緊急事態宣言中は、REMSの適用条件を緩和している。
management-systems-rev-2_en.pdf
https://www.ema.europa.eu/en/documents/scientificguideline/guideline-good-pharmacovigilance-practices-module-xvi-riskminimisation-measures-selection-tools_en-3.pdf
*1
医薬品安全性監視に関しては、別途、安全性に関連した研究の実施を製造販売業者に要請できるPost-marketing requirements(PMR、罰則あり)、Post-marketing commitments (PMC、罰則なし)制度がある。
*2
医薬品リスク管理計画に関する質疑応答集(Q&A)のQ33。
18
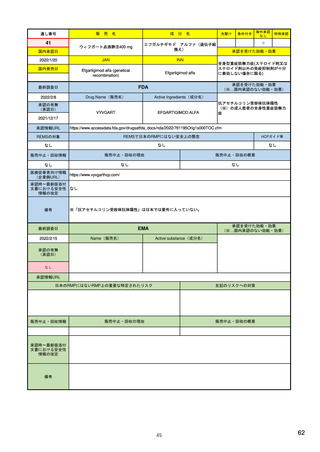
米国
(構成4)
リスク最小化計画
欧州
日本
・メディケーションガイドまたは患者向添付文書(PPI)の作成及び提供
・通常のリスク最小化活動
・通常のリスク最小化活動
(平易な表現による患者の理解促進、安全性注意喚起)
(添付文書(SmPC)・患者向医薬品ガイド(PIL)の作成及び提供)
(添付文書・患者向医薬品ガイドの作成及び提供)
・コミュニケーションプランの策定及び実施
・追加のリスク最小化活動
・追加のリスク最小化活動
(医療従事者向けの理解促進、安全性注意喚起資材配布など)
(教育プログラム、アクセス制御プログラム、流通管理システム、妊娠予防
(市販直後調査による情報提供、適正使用のための資材配布、使用条件の設
・患者アクセス管理システムETASU (Elements to Assure Safe Use)の策定
(回避)プログラム、医療従事者への直接情報伝達(DHPC)など)
定、医療従事者への追加の情報提供、患者への情報提供、表示・容器等の工
及び実装
夫など)
(施術者の訓練、患者レジストリ登録、医療実施施設の認証など)
____________________
・REMS計画の効果に関する評価
追加の措置の必要性を検討するにあたって考慮する点の例
(評価計画、評価分類、評価指標、評価データソース、有効性の閾値設定な
○推定使用患者数 ○投与状況 ○特定されているリスク集団 ○対象疾患の重
ど)
篤性、合併症の重篤性及び背景発現率 ○副作用がベネフィット・リスクバラ
ンス又は保健衛生の状況に対して及ぼす影響の大きさ ○重篤な副作用の重症
度、頻度、可逆性及び予防可能性 ○リスク最小化活動の実施により期待され
る効果 ○海外での開発又は製造販売の状況 ○海外との安全性プロファイル
の相違 ○海外で実施されている調査・試験の状況及び結果 ○海外で執られ
た安全対策
評価方法
見直し
・プロセス評価
・アウトカム評価
・アウトカム評価
・承認から少なくとも1.5, 3, 7年後に評価した結果により、変更または削除
・初回承認から5年後(販売承認更新時)
・再審査申請時
・5年更新後から最初の定期的安全性最新報告(PSUR)を提出する時
・計画書に明記された各活動の節目となる時期
https://www.fda.gov/regulatory-information/selected-amendments-fdc-
https://eur-
https://www.pmda.go.jp/files/000145482.pdf
act/food-and-drug-administration-amendments-act-fdaaa-2007
lex.europa.eu/LexUriServ/LexUriServ.do?uri=CONSLEG:2001L0083:20110 https://www.pmda.go.jp/files/000143723.pdf
https://www.fda.gov/media/100307/download
721:EN:PDF
https://www.pmda.go.jp/files/000145421.pdf
https://www.fda.gov/media/119790/download
https://www.ema.europa.eu/en/documents/scientific-
https://www.pmda.go.jp/files/000221117.pdf
https://www.fda.gov/media/136317/download
guideline/guideline-good-pharmacovigilance-practices-module-v-risk-
(更新は随時)
備考
出典
医薬品、副作用の特性に応じ、可能な範囲の評価方法で評価*2
・プロセス評価
COVID-19による緊急事態宣言中は、REMSの適用条件を緩和している。
management-systems-rev-2_en.pdf
https://www.ema.europa.eu/en/documents/scientificguideline/guideline-good-pharmacovigilance-practices-module-xvi-riskminimisation-measures-selection-tools_en-3.pdf
*1
医薬品安全性監視に関しては、別途、安全性に関連した研究の実施を製造販売業者に要請できるPost-marketing requirements(PMR、罰則あり)、Post-marketing commitments (PMC、罰則なし)制度がある。
*2
医薬品リスク管理計画に関する質疑応答集(Q&A)のQ33。
18