よむ、つかう、まなぶ。
【資料1-1】 医薬品等行政評価・監視委員会における海外調査の状況 (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
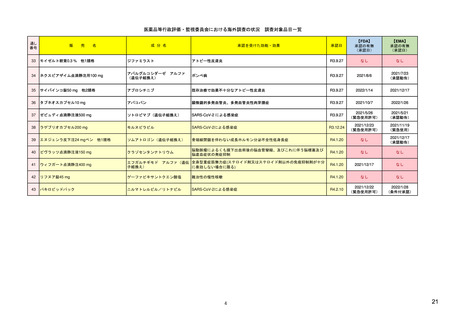
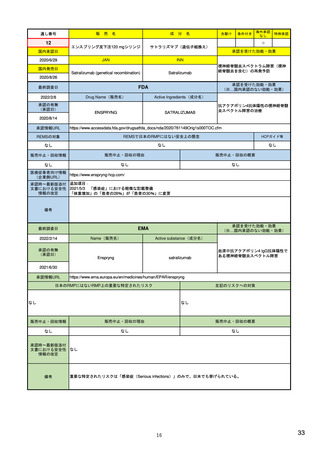
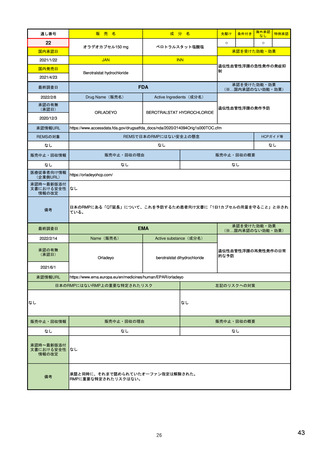
ア.別添「市販後における医薬品の副作用情報収集及び評価のシステム」
R4.3.4
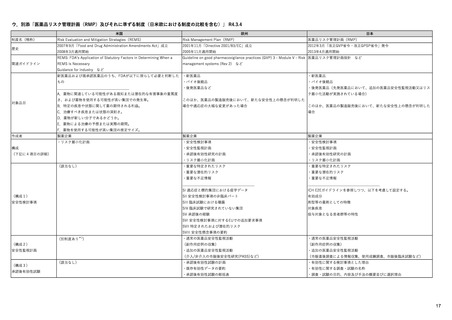
米国
定期的有害事象報告(PADER)の報告頻度
市販後の安全性定期報告
欧州
1)(443-446行目)
日本
定期的安全性最新報告(PSUR)の報告頻度 13)
は、承認3年以内は四半期毎(期間満了日か
は、承認後2年間は6カ月毎、その後2年間は
ら30日以内)、それ以降は1年毎(承認月日
1年毎、その後は3年毎に提出
から60日以内)(定期的ベネフィット・リ
(実質的に、PBRERの様式で作成)。
https://www.ema.europa.eu/en
/human-regulatory/postauthorisation/pharmacovigilance
PBRERの報告頻度は、承認日から2年間は半年 23) 安全性定期報告の手引き
以内毎、それ以降は1年以内毎に、その期間の
満了日から70日以内に行う。
/periodic-safety-update-reports-
スク評価報告(PBRER)に置き換えて報告も
psurs#submission-of-psurs-
可能)。
section
(https://www.jpma.or.jp/info
rmation/evaluation/results/all
otment/lofurc000000sqxfatt/safety_202109.pdf)
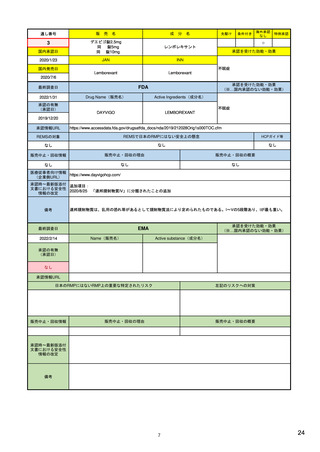
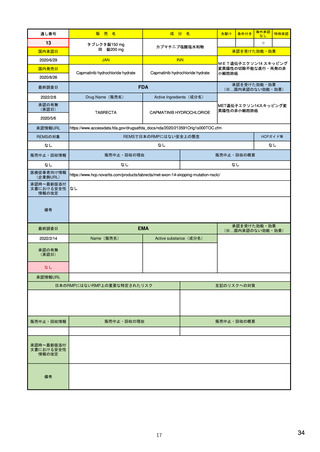
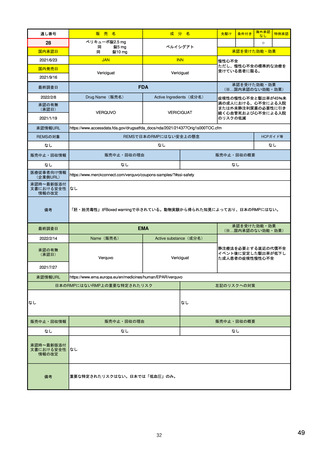
2)副作用(個別症例安全性)報告データベース
FAERS(FDA有害事象報告システム)
データベースの名称
3)
EudraVigilance (EU医薬品規制当局安全性監 14) EudraVigilance |
https://www.fda.gov/drugs
視)
JADER(日本の医薬品副作用データベース)
24)
European Medicines Agency
https://www.pmda.go.jp/sa
/surveillance/questions-
https://www.ema.europa.eu/
fety/info-
and-answers-fdas-
en/human-
services/drugs/adr-
adverse-event-reporting-
regulatory/research-
info/suspected-
system-faers
development/pharmacovigilan
adr/0004.html
ce/eudravigilance
収載されている副作用情報源
・自発的報告(文献情報を含む)
2)
・自発的報告(文献報告を含む)
・非自発的報告(臨床試験、臨床研究、
https://www.fda.gov/media
・非自発的報告(臨床試験、臨床研究、
・非自発的報告(臨床試験等)
等)
(製薬企業、医療従事者、消費者等からの報
(製薬企業、医療従事者、消費者等からの
(製薬企業、医療従事者、消費者等からの
告)
報告)
報告)
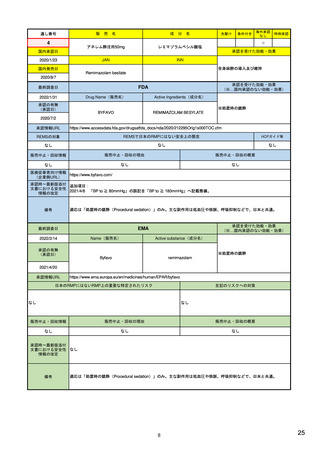
FAERSの四半期ごとのデータファイルをダウ 3)FDA Adverse Event
EudraVigilanceデータへのアクセス可能なレ 15) Access to EudraVigilance
毎月更新するデータセットをダウンロード可
ベルは、製薬企業、EEA内の規制当局、アカ data
能。アクセス・ダウンロードに、所属機関によ 告に関する情報
等)
ンロード可能。アクセス・ダウンロード
に、所属機関による制限なし。
/71228/download
Reporting System (FAERS):
Latest Quarterly Data Files
https://www.fda.gov/drugs/q
デミア、WHO-ウプサラモニタリングセン
10) (p11-, IV.B.1.1. VI.B.1.2.)
https://www.ema.europa.eu/en
/human-regulatory/research-
・自発的報告(文献情報を含む)
る制限なし。
uestions-and-answers-fdas- ター、EEA外の規制当局ごとに規定されてい development/pharmacovigilance
*
adverse-event-reporting/eudravigilance/accessる
個別症例データセットの公開
system-faers/fda-adverse-
24)
25) 副作用が疑われる症例報
https://www.pmda.go.jp/safet
y/info-services/drugs/adrinfo/suspected-adr/0005.html
eudravigilance-data
event-reporting-systemfaers-latest-quarterly-datafiles
FAERSデータを、販売名/成分名、副作用名 4)FDA Adverse Event
等で検索し、年代、年齢層、性別、報告
ラインリストまたは集計データ
者、副作用別の集計症例数を閲覧可能。
Reporting System (FAERS)
Public Dashboard | FDA
の公開
EudraVigilance収載データを販売名/成分名 16)
で検索し、年代、年齢層、性別、報告国、
報告者、副作用別の集計症例数を閲覧可
https://www.adrreports.eu/e
n/search.html
副作用が疑われる症例報告データを、販売名/一 26) 医薬品医療機器情報提供
般名、副作用名で検索し、ラインリスト(個別 ホームページ 副作用が疑
症例報告)、年次別の集計症例数を閲覧可能。
能。
われる症例報告に関する情
報
https://www.info.pmda.go.j
p/fsearchnew/jsp/menu_fu
kusayou_base.jsp
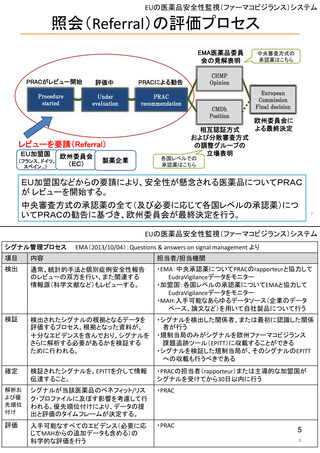
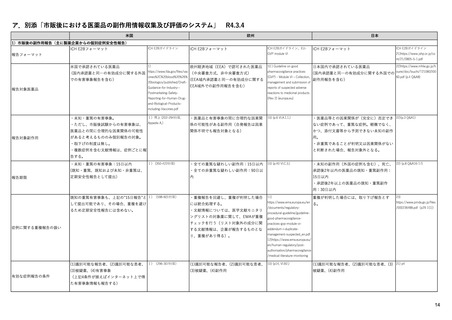
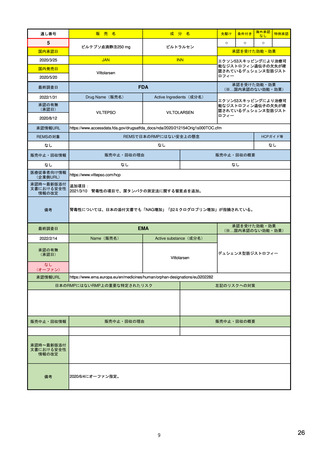
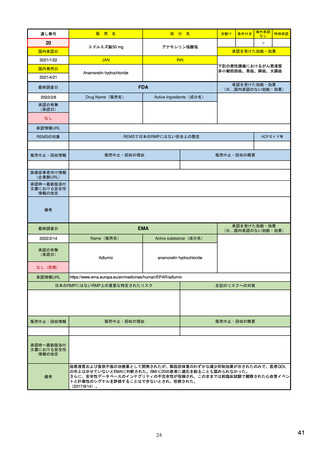
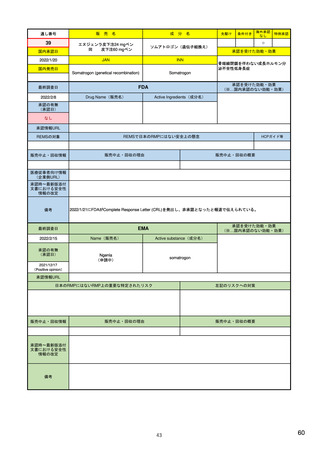
3)副作用情報からの安全性シグナルの検出・評価プロセス
医薬品評価研究センターの監視・疫学部
5)
医薬品安全性監視リスク評価委員会
17)
PMDA 医薬品安全対策第一部・第二部
27)
生物製品評価研究センターの生物統計・疫
https://www.fda.gov/about-
(PRAC、主に検証・評価)
https://www.ema.europa.eu/en
(製薬企業も責任を有している)
https://www.pmda.go.jp/fil
学部
副作用の評価担当部門/委員会
fda/fda-organization/centerdrug-evaluation-andresearch-cder
(製薬企業も責任を有している)
/human-regulatory/post-
es/000242993.pdf
authorisation/pharmacovigilance
/signal-management
6)
https://www.fda.gov/aboutfda/fda-organization/centerbiologics-evaluation-andresearch-cber
15
R4.3.4
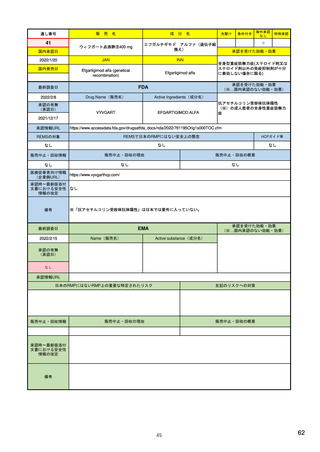
米国
定期的有害事象報告(PADER)の報告頻度
市販後の安全性定期報告
欧州
1)(443-446行目)
日本
定期的安全性最新報告(PSUR)の報告頻度 13)
は、承認3年以内は四半期毎(期間満了日か
は、承認後2年間は6カ月毎、その後2年間は
ら30日以内)、それ以降は1年毎(承認月日
1年毎、その後は3年毎に提出
から60日以内)(定期的ベネフィット・リ
(実質的に、PBRERの様式で作成)。
https://www.ema.europa.eu/en
/human-regulatory/postauthorisation/pharmacovigilance
PBRERの報告頻度は、承認日から2年間は半年 23) 安全性定期報告の手引き
以内毎、それ以降は1年以内毎に、その期間の
満了日から70日以内に行う。
/periodic-safety-update-reports-
スク評価報告(PBRER)に置き換えて報告も
psurs#submission-of-psurs-
可能)。
section
(https://www.jpma.or.jp/info
rmation/evaluation/results/all
otment/lofurc000000sqxfatt/safety_202109.pdf)
2)副作用(個別症例安全性)報告データベース
FAERS(FDA有害事象報告システム)
データベースの名称
3)
EudraVigilance (EU医薬品規制当局安全性監 14) EudraVigilance |
https://www.fda.gov/drugs
視)
JADER(日本の医薬品副作用データベース)
24)
European Medicines Agency
https://www.pmda.go.jp/sa
/surveillance/questions-
https://www.ema.europa.eu/
fety/info-
and-answers-fdas-
en/human-
services/drugs/adr-
adverse-event-reporting-
regulatory/research-
info/suspected-
system-faers
development/pharmacovigilan
adr/0004.html
ce/eudravigilance
収載されている副作用情報源
・自発的報告(文献情報を含む)
2)
・自発的報告(文献報告を含む)
・非自発的報告(臨床試験、臨床研究、
https://www.fda.gov/media
・非自発的報告(臨床試験、臨床研究、
・非自発的報告(臨床試験等)
等)
(製薬企業、医療従事者、消費者等からの報
(製薬企業、医療従事者、消費者等からの
(製薬企業、医療従事者、消費者等からの
告)
報告)
報告)
FAERSの四半期ごとのデータファイルをダウ 3)FDA Adverse Event
EudraVigilanceデータへのアクセス可能なレ 15) Access to EudraVigilance
毎月更新するデータセットをダウンロード可
ベルは、製薬企業、EEA内の規制当局、アカ data
能。アクセス・ダウンロードに、所属機関によ 告に関する情報
等)
ンロード可能。アクセス・ダウンロード
に、所属機関による制限なし。
/71228/download
Reporting System (FAERS):
Latest Quarterly Data Files
https://www.fda.gov/drugs/q
デミア、WHO-ウプサラモニタリングセン
10) (p11-, IV.B.1.1. VI.B.1.2.)
https://www.ema.europa.eu/en
/human-regulatory/research-
・自発的報告(文献情報を含む)
る制限なし。
uestions-and-answers-fdas- ター、EEA外の規制当局ごとに規定されてい development/pharmacovigilance
*
adverse-event-reporting/eudravigilance/accessる
個別症例データセットの公開
system-faers/fda-adverse-
24)
25) 副作用が疑われる症例報
https://www.pmda.go.jp/safet
y/info-services/drugs/adrinfo/suspected-adr/0005.html
eudravigilance-data
event-reporting-systemfaers-latest-quarterly-datafiles
FAERSデータを、販売名/成分名、副作用名 4)FDA Adverse Event
等で検索し、年代、年齢層、性別、報告
ラインリストまたは集計データ
者、副作用別の集計症例数を閲覧可能。
Reporting System (FAERS)
Public Dashboard | FDA
の公開
EudraVigilance収載データを販売名/成分名 16)
で検索し、年代、年齢層、性別、報告国、
報告者、副作用別の集計症例数を閲覧可
https://www.adrreports.eu/e
n/search.html
副作用が疑われる症例報告データを、販売名/一 26) 医薬品医療機器情報提供
般名、副作用名で検索し、ラインリスト(個別 ホームページ 副作用が疑
症例報告)、年次別の集計症例数を閲覧可能。
能。
われる症例報告に関する情
報
https://www.info.pmda.go.j
p/fsearchnew/jsp/menu_fu
kusayou_base.jsp
3)副作用情報からの安全性シグナルの検出・評価プロセス
医薬品評価研究センターの監視・疫学部
5)
医薬品安全性監視リスク評価委員会
17)
PMDA 医薬品安全対策第一部・第二部
27)
生物製品評価研究センターの生物統計・疫
https://www.fda.gov/about-
(PRAC、主に検証・評価)
https://www.ema.europa.eu/en
(製薬企業も責任を有している)
https://www.pmda.go.jp/fil
学部
副作用の評価担当部門/委員会
fda/fda-organization/centerdrug-evaluation-andresearch-cder
(製薬企業も責任を有している)
/human-regulatory/post-
es/000242993.pdf
authorisation/pharmacovigilance
/signal-management
6)
https://www.fda.gov/aboutfda/fda-organization/centerbiologics-evaluation-andresearch-cber
15