よむ、つかう、まなぶ。
【資料1-1】 医薬品等行政評価・監視委員会における海外調査の状況 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
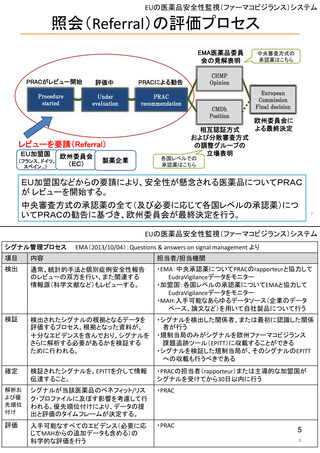
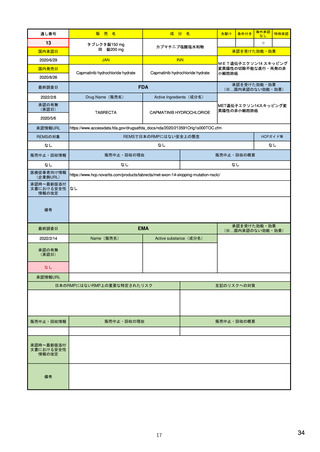
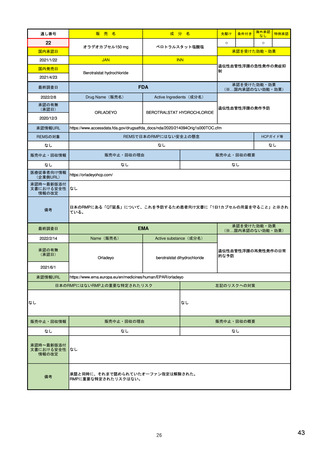
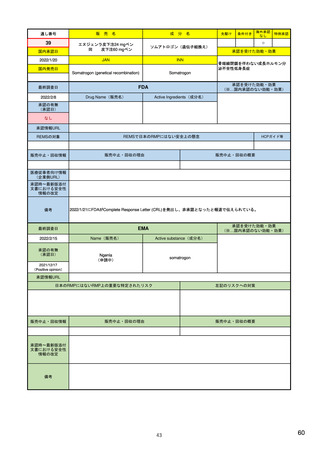
ウ.別添「医薬品リスク管理計画(RMP)及びそれに準ずる制度(日米欧における制度の比較を含む)」 R4.3.4
米国
制度名(略称)
歴史
関連ガイドライン
欧州
Risk Evaluation and Mitigation Stratagies(REMS)
Risk Management Plan(RMP)
医薬品リスク管理計画(RMP)
2007年9月「Food and Drug Administration Amendments Act」成立
2001年11月「Directive 2001/83/EC」成立
2012年3月「改正GVP省令・改正GPSP省令」発令
2008年3月適用開始
2005年11月適用開始
2013年4月適用開始
REMS: FDA’s Application of Statutory Factors in Determining When a
Guideline on good pharmacovigilance practices (GVP) 3 - Module V - Risk 医薬品リスク管理計画指針
REMS Is Necessary
management systems (Rev 2)
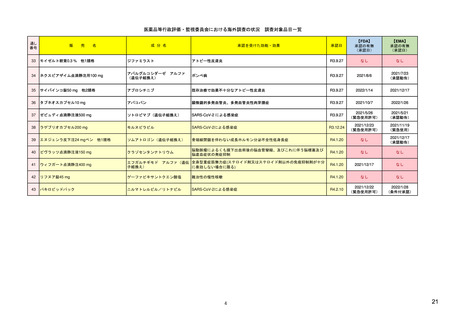
Guidance for Industry
など
など
など
新医薬品および既承認医薬品のうち、FDAが以下に照らして必要と判断した ・新医薬品
・新医薬品
もの
・バイオ後続品
・バイオ後続品
____________________
・後発医薬品など
・後発医薬品(先発医薬品において、追加の医薬品安全性監視活動又はリス
A.薬物に関連している可能性がある既知または潜在的な有害事象の重篤度
対象品目
日本
ク最小化活動が実施されている場合)
さ、および薬物を使用する可能性が高い集団での発生率。
このほか、医薬品の製造販売後において、新たな安全性上の懸念が判明した
B.特定の疾患や状態に関して薬の期待される利益。
場合や適応症の大幅な変更があった場合
C.治療すべき疾患または状態の深刻さ。
このほか、医薬品の製造販売後において、新たな安全性上の懸念が判明した
場合
D.薬物が新しい分子であるかどうか。
E.薬物による治療の予想または実際の期間。
F.薬物を使用する可能性が高い集団の推定サイズ。
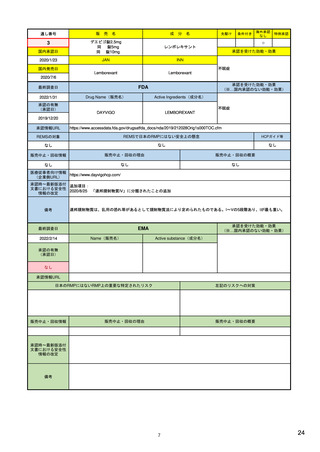
作成者
製薬企業
製薬企業
製薬企業
・リスク最小化計画
・安全性検討事項
・安全性検討事項
構成
・安全性監視計画
・安全性監視計画
(下記に4項目の詳細)
・承認後有効性研究の計画
・承認後有効性研究の計画
・リスク最小化計画
・リスク最小化計画
・重要な特定されたリスク
・重要な特定されたリスク
・重要な潜在的リスク
・重要な潜在的リスク
・重要な不足情報
・重要な不足情報
____________________
____________________
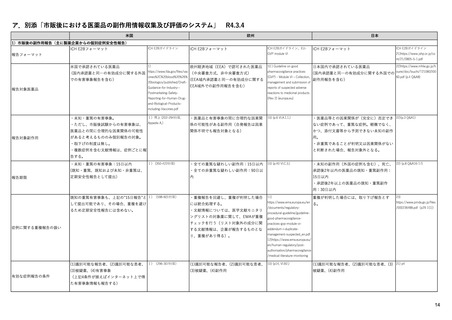
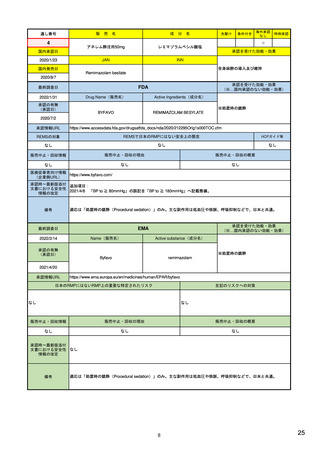
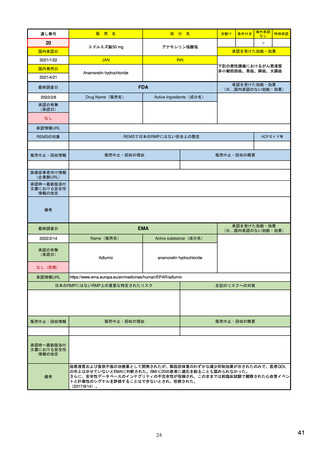
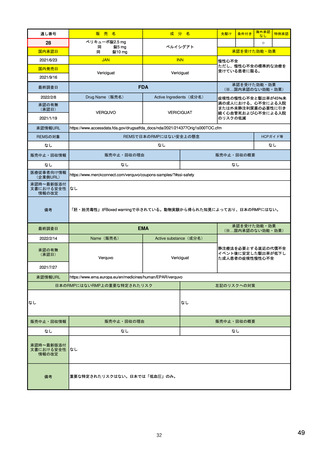
SI 適応症と標的集団における疫学データ
ICH E2Eガイドラインを参照しつつ、以下を考慮して設定する。
(構成1)
SII 安全性検討事項の非臨床パート
有効成分
安全性検討事項
SIII 臨床試験における曝露
剤型等の薬剤としての特徴
SIV 臨床試験で研究されていない集団
対象疾患
SV 承認後の経験
投与対象となる患者群等の特性
(該当なし)
SVI 安全性検討事項に対するEUでの追加要求事項
SVII 特定されたおよび潜在的リスク
SVIII 安全性懸念事項の要約
(別制度あり*1)
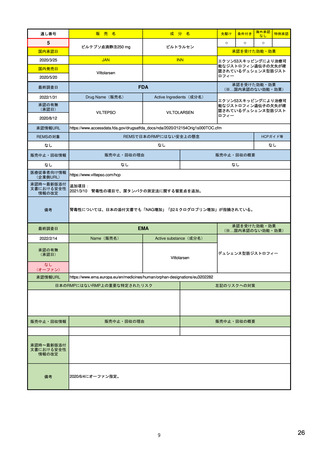
・通常の医薬品安全性監視活動
・通常の医薬品安全性監視活動
(構成2)
(副作用症例の収集)
(副作用症例の収集)
安全性監視計画
・追加の医薬品安全性監視活動
・追加の医薬品安全性監視活動
(介入/非介入の市販後安全性研究(PASS)など)
(市販直後調査による情報収集、使用成績調査、市販後臨床試験など)
・承認後有効性試験の計画
・有効性に関する検討事項とした理由
・既存有効性データの要約
・有効性に関する調査・試験の名称
・承認後有効性試験の総括表
・調査・試験の目的、内容及び手法の概要並びに選択理由
(構成3)
承認後有効性試験
(該当なし)
17
米国
制度名(略称)
歴史
関連ガイドライン
欧州
Risk Evaluation and Mitigation Stratagies(REMS)
Risk Management Plan(RMP)
医薬品リスク管理計画(RMP)
2007年9月「Food and Drug Administration Amendments Act」成立
2001年11月「Directive 2001/83/EC」成立
2012年3月「改正GVP省令・改正GPSP省令」発令
2008年3月適用開始
2005年11月適用開始
2013年4月適用開始
REMS: FDA’s Application of Statutory Factors in Determining When a
Guideline on good pharmacovigilance practices (GVP) 3 - Module V - Risk 医薬品リスク管理計画指針
REMS Is Necessary
management systems (Rev 2)
Guidance for Industry
など
など
など
新医薬品および既承認医薬品のうち、FDAが以下に照らして必要と判断した ・新医薬品
・新医薬品
もの
・バイオ後続品
・バイオ後続品
____________________
・後発医薬品など
・後発医薬品(先発医薬品において、追加の医薬品安全性監視活動又はリス
A.薬物に関連している可能性がある既知または潜在的な有害事象の重篤度
対象品目
日本
ク最小化活動が実施されている場合)
さ、および薬物を使用する可能性が高い集団での発生率。
このほか、医薬品の製造販売後において、新たな安全性上の懸念が判明した
B.特定の疾患や状態に関して薬の期待される利益。
場合や適応症の大幅な変更があった場合
C.治療すべき疾患または状態の深刻さ。
このほか、医薬品の製造販売後において、新たな安全性上の懸念が判明した
場合
D.薬物が新しい分子であるかどうか。
E.薬物による治療の予想または実際の期間。
F.薬物を使用する可能性が高い集団の推定サイズ。
作成者
製薬企業
製薬企業
製薬企業
・リスク最小化計画
・安全性検討事項
・安全性検討事項
構成
・安全性監視計画
・安全性監視計画
(下記に4項目の詳細)
・承認後有効性研究の計画
・承認後有効性研究の計画
・リスク最小化計画
・リスク最小化計画
・重要な特定されたリスク
・重要な特定されたリスク
・重要な潜在的リスク
・重要な潜在的リスク
・重要な不足情報
・重要な不足情報
____________________
____________________
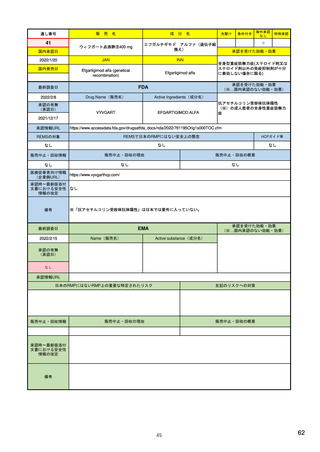
SI 適応症と標的集団における疫学データ
ICH E2Eガイドラインを参照しつつ、以下を考慮して設定する。
(構成1)
SII 安全性検討事項の非臨床パート
有効成分
安全性検討事項
SIII 臨床試験における曝露
剤型等の薬剤としての特徴
SIV 臨床試験で研究されていない集団
対象疾患
SV 承認後の経験
投与対象となる患者群等の特性
(該当なし)
SVI 安全性検討事項に対するEUでの追加要求事項
SVII 特定されたおよび潜在的リスク
SVIII 安全性懸念事項の要約
(別制度あり*1)
・通常の医薬品安全性監視活動
・通常の医薬品安全性監視活動
(構成2)
(副作用症例の収集)
(副作用症例の収集)
安全性監視計画
・追加の医薬品安全性監視活動
・追加の医薬品安全性監視活動
(介入/非介入の市販後安全性研究(PASS)など)
(市販直後調査による情報収集、使用成績調査、市販後臨床試験など)
・承認後有効性試験の計画
・有効性に関する検討事項とした理由
・既存有効性データの要約
・有効性に関する調査・試験の名称
・承認後有効性試験の総括表
・調査・試験の目的、内容及び手法の概要並びに選択理由
(構成3)
承認後有効性試験
(該当なし)
17