よむ、つかう、まなぶ。
25 令和6年度薬価制度改革の概要 (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000196352_00012.html |
| 出典情報 | 令和6年度診療報酬改定説明資料等について(3/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
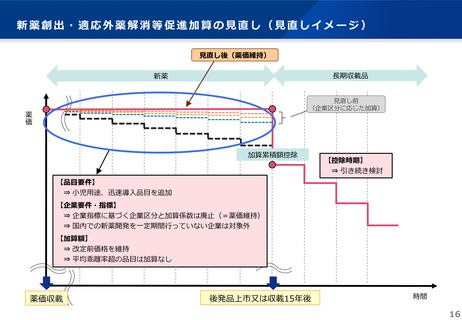
1.(2)新薬創出・適応外薬解消等促進加算の見直し
薬価制度改革の骨子
①新薬創出等加算の見直し【基準改正】
• 新薬創出・適応外薬解消等促進加算(以下「新薬創出等加算」という。)を革新的新薬の薬価を維持する制度とするため、以下の
とおり見直すこととする。
<企業要件・企業指標>
• 制度が試行的に導入された当初から未承認薬・適応外薬の解消等の取組を評価する趣旨で企業の取組を評価していたが、
➢ 品目要件により革新的な医薬品を評価の対象とすることで、このような品目の開発促進という企業側のインセンティブにつな
がると考えられること
➢ 企業要件・企業指標は企業の規模に依存するところがあり、ベンチャー企業やスタートアップ企業では高いポイントを得られ
にくい状況であること
等を考慮し、企業指標に基づく加算係数の設定(加算額の調整)については廃止する。
• 企業指標は廃止するが、本制度において革新的医薬品の国内開発を進め
ていく趣旨を継続させるため、新薬創出等加算の対象となる企業につい
ては、現行の対象企業の要件に加え、上記加算係数の設定に用いた企業
指標に倣い別添1の項目のとおり企業ごとの開発状況を確認し、過去5
年間いずれの項目も満たさない場合には、新薬創出等加算の加算対象外
とする。
• なお、別添1の確認事項に関しては、新薬創出等加算の対象企業の確認
に用いるとともに、「第3 その他 (1)ドラッグ・ラグ/ドラッ
グ・ロスの解消、イノベーションの適切な評価」における検証において
も活用する。
【別添1】
確認事項(過去5年の実績)
A-1
国内試験(日本を含む国際共同試験を含む)(実施数)
(PhaseⅡ以降)
A-2
新薬収載実績(収載成分数)
A-3
革新性のある新薬の収載実績(収載成分数)
A-4
薬剤耐性菌の治療薬の収載実績(収載成分数)
A-5
新型コロナウイルスの治療等に用いる医薬品の開発実績
(承認取得数)
B-1
開発公募品(開発着手数)(B-2分を除く)
B-2
開発公募品(承認取得数)
C-1
世界に先駆けた新薬の開発(品目数)
C-2
特定の用途に係る医薬品の開発(品目数)
(A-4分を除く)
14
薬価制度改革の骨子
①新薬創出等加算の見直し【基準改正】
• 新薬創出・適応外薬解消等促進加算(以下「新薬創出等加算」という。)を革新的新薬の薬価を維持する制度とするため、以下の
とおり見直すこととする。
<企業要件・企業指標>
• 制度が試行的に導入された当初から未承認薬・適応外薬の解消等の取組を評価する趣旨で企業の取組を評価していたが、
➢ 品目要件により革新的な医薬品を評価の対象とすることで、このような品目の開発促進という企業側のインセンティブにつな
がると考えられること
➢ 企業要件・企業指標は企業の規模に依存するところがあり、ベンチャー企業やスタートアップ企業では高いポイントを得られ
にくい状況であること
等を考慮し、企業指標に基づく加算係数の設定(加算額の調整)については廃止する。
• 企業指標は廃止するが、本制度において革新的医薬品の国内開発を進め
ていく趣旨を継続させるため、新薬創出等加算の対象となる企業につい
ては、現行の対象企業の要件に加え、上記加算係数の設定に用いた企業
指標に倣い別添1の項目のとおり企業ごとの開発状況を確認し、過去5
年間いずれの項目も満たさない場合には、新薬創出等加算の加算対象外
とする。
• なお、別添1の確認事項に関しては、新薬創出等加算の対象企業の確認
に用いるとともに、「第3 その他 (1)ドラッグ・ラグ/ドラッ
グ・ロスの解消、イノベーションの適切な評価」における検証において
も活用する。
【別添1】
確認事項(過去5年の実績)
A-1
国内試験(日本を含む国際共同試験を含む)(実施数)
(PhaseⅡ以降)
A-2
新薬収載実績(収載成分数)
A-3
革新性のある新薬の収載実績(収載成分数)
A-4
薬剤耐性菌の治療薬の収載実績(収載成分数)
A-5
新型コロナウイルスの治療等に用いる医薬品の開発実績
(承認取得数)
B-1
開発公募品(開発着手数)(B-2分を除く)
B-2
開発公募品(承認取得数)
C-1
世界に先駆けた新薬の開発(品目数)
C-2
特定の用途に係る医薬品の開発(品目数)
(A-4分を除く)
14