よむ、つかう、まなぶ。
25 令和6年度薬価制度改革の概要 (40 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000196352_00012.html |
| 出典情報 | 令和6年度診療報酬改定説明資料等について(3/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
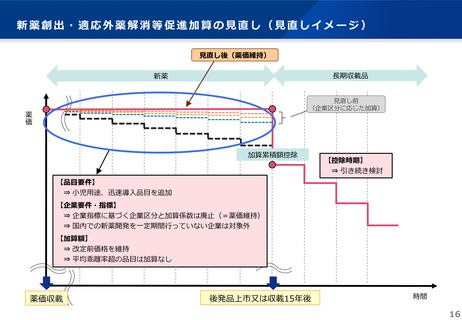
薬価収載時・改定時の加算のまとめ ③
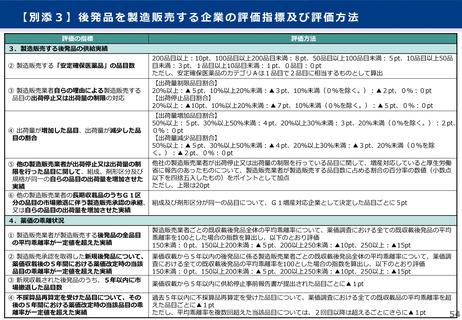
市場拡大再算定における補正加算
算定ルール
(赤字:見直し部分)
1.小児に係る効能及び効果等が追加された既収載品
• 小児に係る効能・効果又は用法・用量が追加されたもの
※ ただし、公知申請など当該、製造販売業者の負担が相当程度低いと認められるものを除く(以下の2.~5.についても同じ)
2.希少疾病に係る効能及び効果等が追加された既収載品
• 希少疾病に係る効能・効果又は用法・用量が追加されたもの(希少疾病用医薬品又はそれに相当すると認められるものに限る)
3.先駆的な効能及び効果等が追加された既収載品
• 効能・効果又は用法・用量が追加された先駆的医薬品
4.特定用途に係る効能及び効果等が追加された既収載品
• 効能・効果又は用法・用量が追加された特定用途医薬品
5.迅速導入により効能及び効果等が追加された既収載品
• 迅速導入加算の要件を満たして効能・効果又は用法・用量が追加された医薬品
6.市販後に真の臨床的有用性が検証された既収載品
• 市販後に集積された調査成績により、真の臨床的有用性が直接的に検証されていることが、国際的に信頼できる学術雑誌への論文
の掲載等を通じて公表されたもの
※ ただし、その根拠となる調査成績が大学等の研究機関により得られたものである場合など、製造販売業者の負担が相当程度低いと認められるものを除く
7.小児用の開発計画に基づき開発が進められている既収載品
• 「成人を対象とした医薬品の開発期間中に行う小児用医薬品の開発計画の策定について」(厚生労働省医薬局医薬品審査管理課長通知)
に基づきPMDAの確認を受けた小児用医薬品の開発計画に基づき遅滞なく開発が進められている品目
注)追加された効能・効果又は用法・用量ごとに加算への該当性を評価
(単一効能・効果等において1.~5.の複数の加算に該当する場合には、加算率が最も大きいものを採用)
40
市場拡大再算定における補正加算
算定ルール
(赤字:見直し部分)
1.小児に係る効能及び効果等が追加された既収載品
• 小児に係る効能・効果又は用法・用量が追加されたもの
※ ただし、公知申請など当該、製造販売業者の負担が相当程度低いと認められるものを除く(以下の2.~5.についても同じ)
2.希少疾病に係る効能及び効果等が追加された既収載品
• 希少疾病に係る効能・効果又は用法・用量が追加されたもの(希少疾病用医薬品又はそれに相当すると認められるものに限る)
3.先駆的な効能及び効果等が追加された既収載品
• 効能・効果又は用法・用量が追加された先駆的医薬品
4.特定用途に係る効能及び効果等が追加された既収載品
• 効能・効果又は用法・用量が追加された特定用途医薬品
5.迅速導入により効能及び効果等が追加された既収載品
• 迅速導入加算の要件を満たして効能・効果又は用法・用量が追加された医薬品
6.市販後に真の臨床的有用性が検証された既収載品
• 市販後に集積された調査成績により、真の臨床的有用性が直接的に検証されていることが、国際的に信頼できる学術雑誌への論文
の掲載等を通じて公表されたもの
※ ただし、その根拠となる調査成績が大学等の研究機関により得られたものである場合など、製造販売業者の負担が相当程度低いと認められるものを除く
7.小児用の開発計画に基づき開発が進められている既収載品
• 「成人を対象とした医薬品の開発期間中に行う小児用医薬品の開発計画の策定について」(厚生労働省医薬局医薬品審査管理課長通知)
に基づきPMDAの確認を受けた小児用医薬品の開発計画に基づき遅滞なく開発が進められている品目
注)追加された効能・効果又は用法・用量ごとに加算への該当性を評価
(単一効能・効果等において1.~5.の複数の加算に該当する場合には、加算率が最も大きいものを採用)
40