よむ、つかう、まなぶ。
25 令和6年度薬価制度改革の概要 (36 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000196352_00012.html |
| 出典情報 | 令和6年度診療報酬改定説明資料等について(3/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
参考
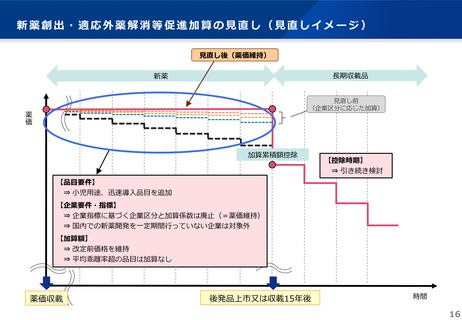
薬事制度における新たな取組み(小児用医薬品の開発計画策定)
• 小児を対象とした医薬品(小児用医薬品)については、医療ニーズが高いにもかかわらず、成人と比べて臨床開発が進みに
くいところ、薬事制度においては、小児用医薬品に対する早期のアクセスを確保する観点から、成人用の開発と同時に小児
用の開発計画の策定を促す仕組みの導入が進められている。
「成人を対象とした医薬品の開発期間中に行う小児用医薬品の開発計画の
策定について」
(令和6年1月12日付け医薬薬審発0112第3号厚生労働省医薬局医薬品審査管理課長通知)
1.小児用医薬品の開発に係る基本的な考え方について
(1) 新有効成分又は新効能等の医薬品について、成人を対象とした医薬
品の開発(効能・効果の追加に係る開発を含む。)を行う場合は、当
該開発の対象となる効能・効果に係る小児用医薬品の開発計画を策定
し、成人を対象とした医薬品の承認申請を行うまでに、独立行政法人
医薬品医療機器総合機構(以下「PMDA」という。)の確認を受ける
とともに、遅滞なく当該開発計画に基づいて開発を進めることが望ま
しい。
なお、成人と小児における効能・効果が異なる医薬品 (例えば、
成人と小児で対象となるがんの種類が異なる場合等)においても、小
児用医薬品の開発計画について PMDAの確認を受けることを妨げるも
のではない。
(2) (1)の小児用医薬品の開発計画について、 成人を対象とした医薬
品の承認申請を行うまでにPMDAの確認を受けることが困難である場
合は、当該承認申請に対する審査終了までの間にPMDAの確認を受け
るとともに、遅滞なく当該開発計画に基づいて開発を進めることが望
ましい。
36
薬事制度における新たな取組み(小児用医薬品の開発計画策定)
• 小児を対象とした医薬品(小児用医薬品)については、医療ニーズが高いにもかかわらず、成人と比べて臨床開発が進みに
くいところ、薬事制度においては、小児用医薬品に対する早期のアクセスを確保する観点から、成人用の開発と同時に小児
用の開発計画の策定を促す仕組みの導入が進められている。
「成人を対象とした医薬品の開発期間中に行う小児用医薬品の開発計画の
策定について」
(令和6年1月12日付け医薬薬審発0112第3号厚生労働省医薬局医薬品審査管理課長通知)
1.小児用医薬品の開発に係る基本的な考え方について
(1) 新有効成分又は新効能等の医薬品について、成人を対象とした医薬
品の開発(効能・効果の追加に係る開発を含む。)を行う場合は、当
該開発の対象となる効能・効果に係る小児用医薬品の開発計画を策定
し、成人を対象とした医薬品の承認申請を行うまでに、独立行政法人
医薬品医療機器総合機構(以下「PMDA」という。)の確認を受ける
とともに、遅滞なく当該開発計画に基づいて開発を進めることが望ま
しい。
なお、成人と小児における効能・効果が異なる医薬品 (例えば、
成人と小児で対象となるがんの種類が異なる場合等)においても、小
児用医薬品の開発計画について PMDAの確認を受けることを妨げるも
のではない。
(2) (1)の小児用医薬品の開発計画について、 成人を対象とした医薬
品の承認申請を行うまでにPMDAの確認を受けることが困難である場
合は、当該承認申請に対する審査終了までの間にPMDAの確認を受け
るとともに、遅滞なく当該開発計画に基づいて開発を進めることが望
ましい。
36