よむ、つかう、まなぶ。
25 令和6年度薬価制度改革の概要 (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000196352_00012.html |
| 出典情報 | 令和6年度診療報酬改定説明資料等について(3/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
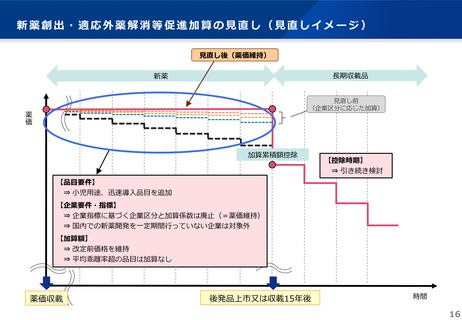
新薬創出・適応外薬解消等促進加算(企業要件)
(赤字:見直し部分)
企業要件
○ 次に掲げる企業以外の企業(改定の都度評価)
・ 未承認薬等検討会議における検討結果を踏まえ、厚生労働省から開発を要請された品目について、開発の拒
否、合理的な理由のない開発の遅延等、適切に対応を行わなかった企業
・ 別表の確認事項について、過去5年いずれの事項にも該当するものがない企業
確認事項(過去5年の実績)
A-1
国内試験(日本を含む国際共同試験を含む)(実施数)
(PhaseⅡ以降)
A-2
新薬収載実績(収載成分数)
A-3
革新性のある新薬の収載実績(収載成分数)
A-4
薬剤耐性菌の治療薬の収載実績(収載成分数)
A-5
新型コロナウイルスの治療等に用いる医薬品の開発実績
(承認取得数)
B-1
開発公募品(開発着手数)(B-2分を除く)
B-2
開発公募品(承認取得数)
C-1
世界に先駆けた新薬の開発(品目数)
C-2
特定の用途に係る医薬品の開発(品目数)
(A-4分を除く)
※ 企業指標及び企業指標に基づく加算係数の設定(加算額の調整)は、廃止
18
(赤字:見直し部分)
企業要件
○ 次に掲げる企業以外の企業(改定の都度評価)
・ 未承認薬等検討会議における検討結果を踏まえ、厚生労働省から開発を要請された品目について、開発の拒
否、合理的な理由のない開発の遅延等、適切に対応を行わなかった企業
・ 別表の確認事項について、過去5年いずれの事項にも該当するものがない企業
確認事項(過去5年の実績)
A-1
国内試験(日本を含む国際共同試験を含む)(実施数)
(PhaseⅡ以降)
A-2
新薬収載実績(収載成分数)
A-3
革新性のある新薬の収載実績(収載成分数)
A-4
薬剤耐性菌の治療薬の収載実績(収載成分数)
A-5
新型コロナウイルスの治療等に用いる医薬品の開発実績
(承認取得数)
B-1
開発公募品(開発着手数)(B-2分を除く)
B-2
開発公募品(承認取得数)
C-1
世界に先駆けた新薬の開発(品目数)
C-2
特定の用途に係る医薬品の開発(品目数)
(A-4分を除く)
※ 企業指標及び企業指標に基づく加算係数の設定(加算額の調整)は、廃止
18