よむ、つかう、まなぶ。
25 令和6年度薬価制度改革の概要 (44 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000196352_00012.html |
| 出典情報 | 令和6年度診療報酬改定説明資料等について(3/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1.(7)その他のイノベーション評価に関する事項(続き)
薬価制度改革の骨子
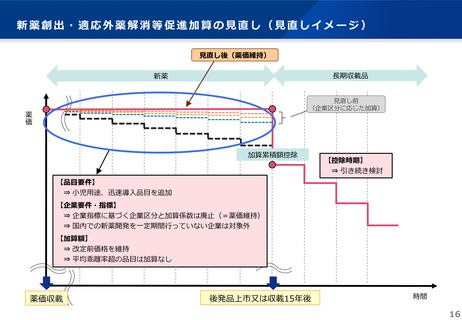
④類似薬効比較方式(Ⅰ)における薬価の適正化
• 原価計算方式に代わり類似薬効比較方式(Ⅰ)による算定をより積極的に実施するのであれば、臨床試験成績、薬事承認内容等か
ら、比較薬とは臨床上の位置づけ等が異なり、単純に一日薬価合わせを行うことが同等の評価とはいえないと考えられる新規収載
品目については、一日薬価を合わせて算定した後、一定の範囲で減算することを可能とする規定を設けることが適当であるが、適
用に当たって考慮すべき因子や調整の幅等については慎重に検討する必要があることから、引き続き検討することとする。
⑤その他
1)新薬に係る薬価制度の見直しに伴う対応及び影響の検証
• ①~③のような取扱いをはじめとして、今回の新薬の薬価収載時等の評価に係る対応に関しては、個別の事例ごとに判断するもの
であるため、薬価算定組織における個別品目で改正内容に係る事項があれば、その点も含め議論するとともに、薬価収載の審議を
行う中医協総会において必要に応じて説明することとする。
• 令和6年度薬価制度改革において行う新薬に係る薬価制度の見直しに伴う医薬品開発への影響について、製薬業界の協力のもとで
分析・評価等を行うこととし、次回以降の薬価制度改革に向けた検討においても、薬価改定による革新的新薬の薬価のあり方につ
いて引き続き議論を行うこととする。(1.(2)②参照)
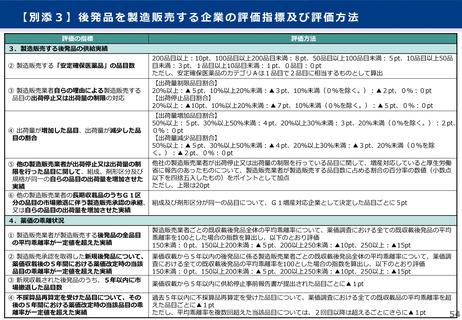
2)薬価基準収載希望書への記載【その他(通知改正)】
• 今回の新薬に係る薬価制度の見直しに伴い、国内外の開発状況等が把握できるよう、薬価基準収載希望書に以下の事項を記載・添
付することを求めることとする。
➢ 開発時における国際共同治験を含む治験の概要概要及びその実施時期
➢ 欧米における承認の有無及びその承認時期
➢ 欧米における小児適用の開発状況
➢ 日本における成人と小児の同時開発に係る計画書及びPMDAとの治験相談記録
44
薬価制度改革の骨子
④類似薬効比較方式(Ⅰ)における薬価の適正化
• 原価計算方式に代わり類似薬効比較方式(Ⅰ)による算定をより積極的に実施するのであれば、臨床試験成績、薬事承認内容等か
ら、比較薬とは臨床上の位置づけ等が異なり、単純に一日薬価合わせを行うことが同等の評価とはいえないと考えられる新規収載
品目については、一日薬価を合わせて算定した後、一定の範囲で減算することを可能とする規定を設けることが適当であるが、適
用に当たって考慮すべき因子や調整の幅等については慎重に検討する必要があることから、引き続き検討することとする。
⑤その他
1)新薬に係る薬価制度の見直しに伴う対応及び影響の検証
• ①~③のような取扱いをはじめとして、今回の新薬の薬価収載時等の評価に係る対応に関しては、個別の事例ごとに判断するもの
であるため、薬価算定組織における個別品目で改正内容に係る事項があれば、その点も含め議論するとともに、薬価収載の審議を
行う中医協総会において必要に応じて説明することとする。
• 令和6年度薬価制度改革において行う新薬に係る薬価制度の見直しに伴う医薬品開発への影響について、製薬業界の協力のもとで
分析・評価等を行うこととし、次回以降の薬価制度改革に向けた検討においても、薬価改定による革新的新薬の薬価のあり方につ
いて引き続き議論を行うこととする。(1.(2)②参照)
2)薬価基準収載希望書への記載【その他(通知改正)】
• 今回の新薬に係る薬価制度の見直しに伴い、国内外の開発状況等が把握できるよう、薬価基準収載希望書に以下の事項を記載・添
付することを求めることとする。
➢ 開発時における国際共同治験を含む治験の概要概要及びその実施時期
➢ 欧米における承認の有無及びその承認時期
➢ 欧米における小児適用の開発状況
➢ 日本における成人と小児の同時開発に係る計画書及びPMDAとの治験相談記録
44