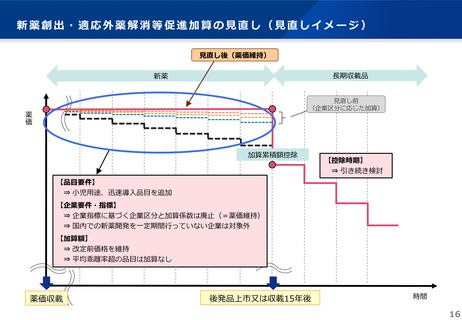
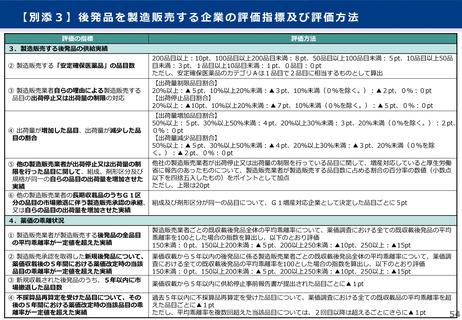
よむ、つかう、まなぶ。
25 令和6年度薬価制度改革の概要 (26 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000196352_00012.html |
| 出典情報 | 令和6年度診療報酬改定説明資料等について(3/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
参考
中医協 薬-1
5.11.10
開発状況等に基づく加算率の評価の考え方
• 最近の国際共同治験など国際的な医薬品開発の状況や、症例数等による治験の実施の困難さ等を基に、研究班の指摘も踏ま
えると、現在規定されている範囲内で、加算率の付与を柔軟に判断することが考えられる。
• なお、加算率については、医薬品の開発状況は様々であり一律の基準を設けることは困難であり、従来から薬価算定組織の
判断で評価されていることから、今後も同様に個別品目ごとに薬価算定組織で判断することが適当と考えられる。
◼ 市場性加算(Ⅰ)[10~20%]
➢ 投与患者数が著しく少なく、市場規模も小さい希少疾病用医薬品(例:500人未満/50億円未満など) につい
ては15%~20%の加算率を適用することが考えられる。
➢ 実施困難な国際共同治験への参加により世界の開発に合わせて日本でも開発されていた場合等には、加算率を
充実させることが考えられる。
◼ 小児加算[5~20%]
➢ 重篤な疾病を適応対象とする場合、新生児・乳児又は低年齢の幼児を対象とした臨床試験が行われた場合、内
容に応じて10~20%の加算率を適用することが考えられる。
➢ 実施困難な国際共同治験への参加により世界の開発に合わせて日本でも開発されていた場合等には、加算率を
充実させることが考えられる。
◼ 先駆加算[10~20%]
➢ 日本が世界で初承認国であった場合に、治験実施の困難さや審査当局との治験相談・審査の手続等を考慮して
15~20%の加算率を適用することが考えられる。
26
中医協 薬-1
5.11.10
開発状況等に基づく加算率の評価の考え方
• 最近の国際共同治験など国際的な医薬品開発の状況や、症例数等による治験の実施の困難さ等を基に、研究班の指摘も踏ま
えると、現在規定されている範囲内で、加算率の付与を柔軟に判断することが考えられる。
• なお、加算率については、医薬品の開発状況は様々であり一律の基準を設けることは困難であり、従来から薬価算定組織の
判断で評価されていることから、今後も同様に個別品目ごとに薬価算定組織で判断することが適当と考えられる。
◼ 市場性加算(Ⅰ)[10~20%]
➢ 投与患者数が著しく少なく、市場規模も小さい希少疾病用医薬品(例:500人未満/50億円未満など) につい
ては15%~20%の加算率を適用することが考えられる。
➢ 実施困難な国際共同治験への参加により世界の開発に合わせて日本でも開発されていた場合等には、加算率を
充実させることが考えられる。
◼ 小児加算[5~20%]
➢ 重篤な疾病を適応対象とする場合、新生児・乳児又は低年齢の幼児を対象とした臨床試験が行われた場合、内
容に応じて10~20%の加算率を適用することが考えられる。
➢ 実施困難な国際共同治験への参加により世界の開発に合わせて日本でも開発されていた場合等には、加算率を
充実させることが考えられる。
◼ 先駆加算[10~20%]
➢ 日本が世界で初承認国であった場合に、治験実施の困難さや審査当局との治験相談・審査の手続等を考慮して
15~20%の加算率を適用することが考えられる。
26