よむ、つかう、まなぶ。
総-2-1医薬品の新規薬価収載等について (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_45183.html |
| 出典情報 | 中央社会保険医療協議会 総会(第598回 11/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
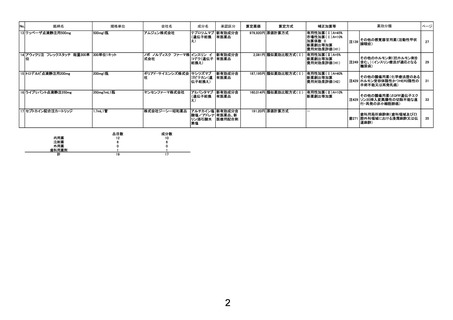
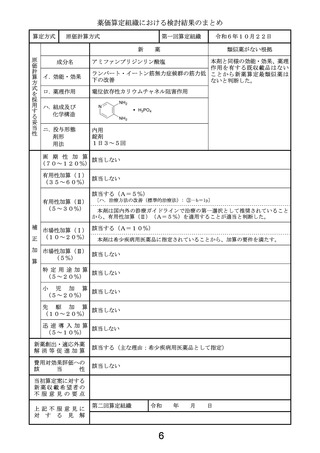
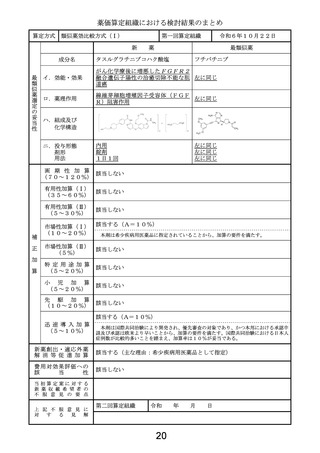
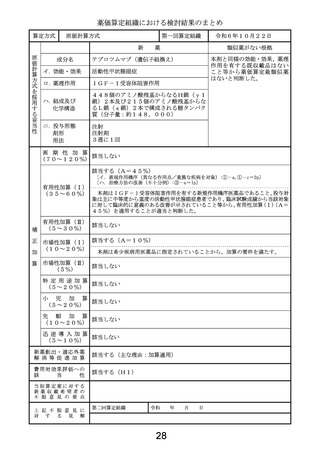
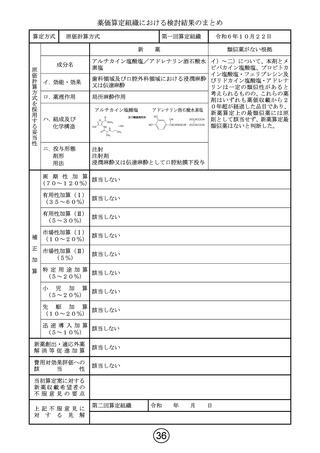
薬価算定組織における検討結果のまとめ
算定方式
類似薬効比較方式(Ⅰ)
第一回算定組織
新
成分名
最
類
似
薬
選
定
の
妥
当
性
令和6年10月22日
薬
最類似薬
ドナネマブ(遺伝子組換え)
レカネマブ(遺伝子組換え)
イ.効能・効果
アルツハイマー病による軽度認知障害及
左に同じ
び軽度の認知症の進行抑制
ロ.薬理作用
脳内アミロイドβ量の減少(アミロイド 脳内アミロイドβ量の減少(アミロイド
βプラーク除去)
βプロトフィブリル減少)
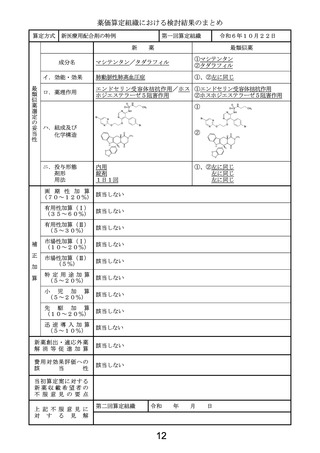
ハ.組成及び
化学構造
444個のアミノ酸残基からなるH鎖(γ
1鎖)2本及び219個のアミノ酸残基か
らなるL鎖(κ鎖)2本で構成される糖タン
パク質(分子量:約148,000)
454個のアミノ酸残基からなるH鎖(γ
1鎖)2本及び219個のアミノ酸残基か
らなるL鎖(κ鎖)2本で構成される糖タン
パク質(分子量:約150,000)
ニ.投与形態
剤形
用法
注射
注射剤
4週に1回
左に同じ
左に同じ
2週に1回
画 期 性 加 算
(70~120%)
該当しない
有用性加算(Ⅰ)
(35~60%)
該当しない
該当する(A=5%)
〔ハ.治療方法の改善(利便性): ③-c=1p〕
有用性加算(Ⅱ)
(5~30%)
補
正
加
算
本剤は、投与を18か月間継続する比較薬と異なり、添付文書において、投与期間が原則
18か月間とされた上で、投与開始後12か月を目安に行われる評価で、アミロイドβプラー
ク除去が確認された場合は投与を完了することとされていることから、有用性加算(Ⅱ)
(A=
5%)を適用することが適当と判断した。
市場性加算(Ⅰ)
(10~20%)
該当しない
市場性加算(Ⅱ)
(5%)
該当しない
特 定 用 途 加 算
(5~20%)
該当しない
小
児
加
算
(5~20%)
該当しない
先
駆
加
算
(10~20%)
該当しない
迅 速 導 入 加 算
(5~10%)
該当しない
新薬創出・適応外薬
解 消 等 促 進 加 算
該当する(主な理由:加算適用)
費用対効果評価への
該
当
性
該当する(H1)
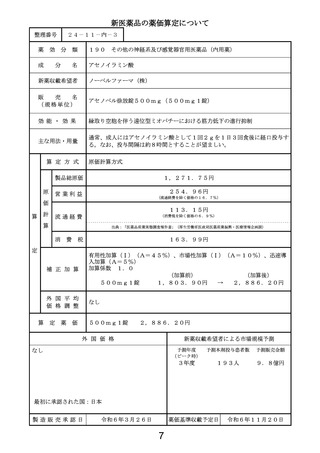
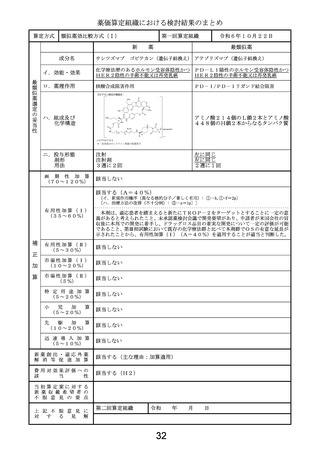
当初算定案に対する
新 薬 収 載 希 望 者 の
不 服 意 見 の 要 点
1日薬価の算出に用いる体重及び投与期間は以下のとおりとすることが適切と考える。
・比較薬の1日薬価の計算に用いる体重として、比較薬の国際共同第Ⅲ相試験における日本
人被験者の平均体重を用いる。
・本剤は投与開始後12か月を目安に行われる評価で、アミロイドβプラーク除去が確認さ
れた場合は投与を完了することとされていることから、本剤の投与期間の計算にあたって
は臨床試験の結果(12か月で投与完了する患者割合)を考慮する。
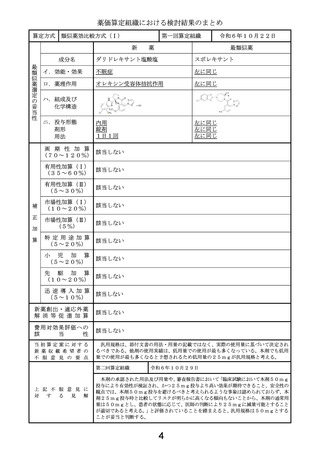
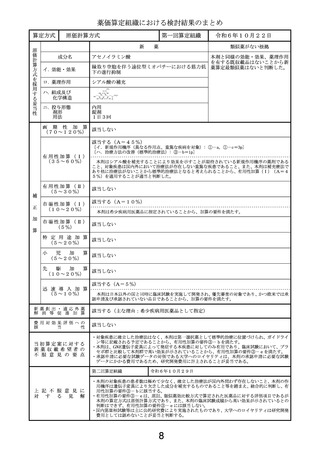
第二回算定組織
上 記 不 服 意 見 に
対
す
る
見
解
令和6年10月29日
以下の理由から、比較薬の1日薬価の算出に用いる体重は50kg、本剤の投与期間は
18か月とすることが妥当と判断する。
・体重当たりの投与量が設定された薬剤では、通常、成人の場合は50kgを用いて1日
薬価を算出しており、臨床試験における平均体重を用いる合理的な理由はない。
・比較薬より早期に投与完了できる点は有用性加算の③-cで既に評価している。
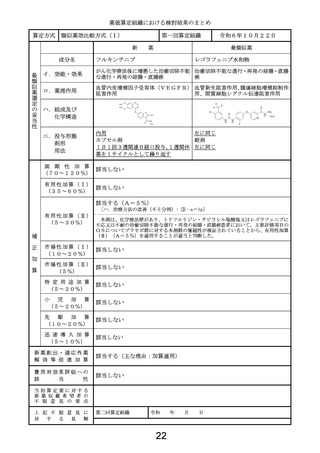
24
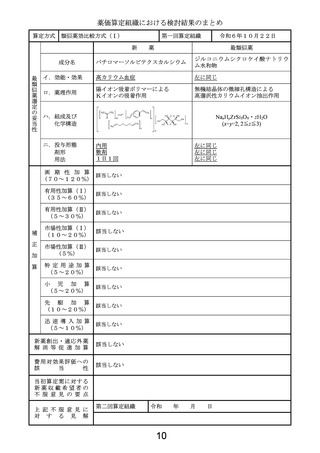
算定方式
類似薬効比較方式(Ⅰ)
第一回算定組織
新
成分名
最
類
似
薬
選
定
の
妥
当
性
令和6年10月22日
薬
最類似薬
ドナネマブ(遺伝子組換え)
レカネマブ(遺伝子組換え)
イ.効能・効果
アルツハイマー病による軽度認知障害及
左に同じ
び軽度の認知症の進行抑制
ロ.薬理作用
脳内アミロイドβ量の減少(アミロイド 脳内アミロイドβ量の減少(アミロイド
βプラーク除去)
βプロトフィブリル減少)
ハ.組成及び
化学構造
444個のアミノ酸残基からなるH鎖(γ
1鎖)2本及び219個のアミノ酸残基か
らなるL鎖(κ鎖)2本で構成される糖タン
パク質(分子量:約148,000)
454個のアミノ酸残基からなるH鎖(γ
1鎖)2本及び219個のアミノ酸残基か
らなるL鎖(κ鎖)2本で構成される糖タン
パク質(分子量:約150,000)
ニ.投与形態
剤形
用法
注射
注射剤
4週に1回
左に同じ
左に同じ
2週に1回
画 期 性 加 算
(70~120%)
該当しない
有用性加算(Ⅰ)
(35~60%)
該当しない
該当する(A=5%)
〔ハ.治療方法の改善(利便性): ③-c=1p〕
有用性加算(Ⅱ)
(5~30%)
補
正
加
算
本剤は、投与を18か月間継続する比較薬と異なり、添付文書において、投与期間が原則
18か月間とされた上で、投与開始後12か月を目安に行われる評価で、アミロイドβプラー
ク除去が確認された場合は投与を完了することとされていることから、有用性加算(Ⅱ)
(A=
5%)を適用することが適当と判断した。
市場性加算(Ⅰ)
(10~20%)
該当しない
市場性加算(Ⅱ)
(5%)
該当しない
特 定 用 途 加 算
(5~20%)
該当しない
小
児
加
算
(5~20%)
該当しない
先
駆
加
算
(10~20%)
該当しない
迅 速 導 入 加 算
(5~10%)
該当しない
新薬創出・適応外薬
解 消 等 促 進 加 算
該当する(主な理由:加算適用)
費用対効果評価への
該
当
性
該当する(H1)
当初算定案に対する
新 薬 収 載 希 望 者 の
不 服 意 見 の 要 点
1日薬価の算出に用いる体重及び投与期間は以下のとおりとすることが適切と考える。
・比較薬の1日薬価の計算に用いる体重として、比較薬の国際共同第Ⅲ相試験における日本
人被験者の平均体重を用いる。
・本剤は投与開始後12か月を目安に行われる評価で、アミロイドβプラーク除去が確認さ
れた場合は投与を完了することとされていることから、本剤の投与期間の計算にあたって
は臨床試験の結果(12か月で投与完了する患者割合)を考慮する。
第二回算定組織
上 記 不 服 意 見 に
対
す
る
見
解
令和6年10月29日
以下の理由から、比較薬の1日薬価の算出に用いる体重は50kg、本剤の投与期間は
18か月とすることが妥当と判断する。
・体重当たりの投与量が設定された薬剤では、通常、成人の場合は50kgを用いて1日
薬価を算出しており、臨床試験における平均体重を用いる合理的な理由はない。
・比較薬より早期に投与完了できる点は有用性加算の③-cで既に評価している。
24