よむ、つかう、まなぶ。
参考資料3-2 事務局 提出資料 (15 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2409_04medical/241125/medical03_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第3回 11/25)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
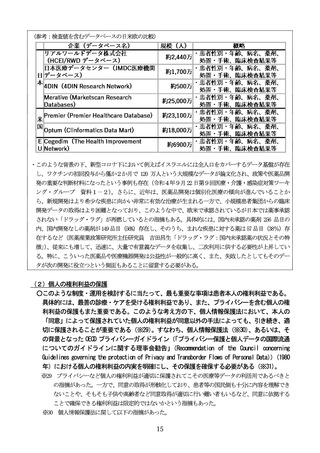
(参考:検査値を含むデータベースの日米欧の比較)
・このような背景の下、新型コロナ下において例えばイスラエルには全人口をカバーするデータ基盤が存在
し、ワクチンの初回投与から僅か2か月で 120 万人という大規模なデータが論文化され、政策や医薬品開
発の重要な判断材料になったという事例も存在(令和4年9月 22 日第9回医療・介護・感染症対策ワーキ
ング・グループ 資料1-2)
。さらに、近年は、医薬品開発は個別化医療の傾向が進んでいることか
ら、新規開発はより希少な疾患に向かい非常に有効な治療が生まれる一方で、小規模患者集団からの臨床
開発データの取得はより困難となっており、このような中で、欧米で承認されているが日本では薬事承認
されない「ドラッグ・ラグ」が再燃しているとの指摘もある。具体的には、国内未承認の薬剤 256 品目の
内、国内開発なしの薬剤が 149 品目(56%)存在し、そのうち、まれな疾患に対する薬は 57 品目(38%)存
在するなど(医薬産業政策研究所主任研究員 吉田昌生「ドラッグ・ラグ:国内未承認薬の状況とその特
徴」
)
、従来にも増して、迅速に、大量で有意義なデータを収集し、二次利用に供する必要性が上昇してい
る。特に、こういった医薬品や医療機器開発は公益性が一般的に高く、また、失敗したとしてもそのデー
タが次の開発に役立つという側面もあることに留意する必要がある。
(2)個人の権利利益の保護
○このような制度・運用を検討するに当たって、最も重要な事項は患者本人の権利利益である。
具体的には、最善の診療・ケアを受ける権利利益であり、また、プライバシーを含む個人の権
利利益の保護もまた重要である。このような考え方の下、個人情報保護法において、本人の
「同意」によって保護されていた個人の権利利益が同意以外の手法によっても、引き続き、適
切に保護されることが重要である(※29)
。すなわち、個人情報保護法(※30)
、あるいは、そ
の背景となった OECD プライバシーガイドライン(
「プライバシー保護と個人データの国際流通
についてのガイドラインに関する理事会勧告」(Recommendation of the Council concerning
Guidelines governing the protection of Privacy and Transborder Flows of Personal Data)
)
(1980
年)における個人の権利利益の内実を明確にし、その保護を確保する必要がある(※31)
。
※29 プライバシーなど個人の権利利益が適切に保護されてこその医療等データの利活用であるべきと
の指摘があった。一方で、同意の取得が形骸化しており、患者等の国民側も十分に内容を理解でき
ないことや、そもそも子供や高齢者など同意取得が適切に行い難い者もいるなど、同意に依拠する
ことで確保できる権利利益は限定的ではないかという指摘もあった。
※30 個人情報保護法に関して以下の指摘があった。
15
・このような背景の下、新型コロナ下において例えばイスラエルには全人口をカバーするデータ基盤が存在
し、ワクチンの初回投与から僅か2か月で 120 万人という大規模なデータが論文化され、政策や医薬品開
発の重要な判断材料になったという事例も存在(令和4年9月 22 日第9回医療・介護・感染症対策ワーキ
ング・グループ 資料1-2)
。さらに、近年は、医薬品開発は個別化医療の傾向が進んでいることか
ら、新規開発はより希少な疾患に向かい非常に有効な治療が生まれる一方で、小規模患者集団からの臨床
開発データの取得はより困難となっており、このような中で、欧米で承認されているが日本では薬事承認
されない「ドラッグ・ラグ」が再燃しているとの指摘もある。具体的には、国内未承認の薬剤 256 品目の
内、国内開発なしの薬剤が 149 品目(56%)存在し、そのうち、まれな疾患に対する薬は 57 品目(38%)存
在するなど(医薬産業政策研究所主任研究員 吉田昌生「ドラッグ・ラグ:国内未承認薬の状況とその特
徴」
)
、従来にも増して、迅速に、大量で有意義なデータを収集し、二次利用に供する必要性が上昇してい
る。特に、こういった医薬品や医療機器開発は公益性が一般的に高く、また、失敗したとしてもそのデー
タが次の開発に役立つという側面もあることに留意する必要がある。
(2)個人の権利利益の保護
○このような制度・運用を検討するに当たって、最も重要な事項は患者本人の権利利益である。
具体的には、最善の診療・ケアを受ける権利利益であり、また、プライバシーを含む個人の権
利利益の保護もまた重要である。このような考え方の下、個人情報保護法において、本人の
「同意」によって保護されていた個人の権利利益が同意以外の手法によっても、引き続き、適
切に保護されることが重要である(※29)
。すなわち、個人情報保護法(※30)
、あるいは、そ
の背景となった OECD プライバシーガイドライン(
「プライバシー保護と個人データの国際流通
についてのガイドラインに関する理事会勧告」(Recommendation of the Council concerning
Guidelines governing the protection of Privacy and Transborder Flows of Personal Data)
)
(1980
年)における個人の権利利益の内実を明確にし、その保護を確保する必要がある(※31)
。
※29 プライバシーなど個人の権利利益が適切に保護されてこその医療等データの利活用であるべきと
の指摘があった。一方で、同意の取得が形骸化しており、患者等の国民側も十分に内容を理解でき
ないことや、そもそも子供や高齢者など同意取得が適切に行い難い者もいるなど、同意に依拠する
ことで確保できる権利利益は限定的ではないかという指摘もあった。
※30 個人情報保護法に関して以下の指摘があった。
15