よむ、つかう、まなぶ。
資料1-3 日本製薬工業協会 御提出資料 (16 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2501_02medical/250331/medical03_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第3回 3/31)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
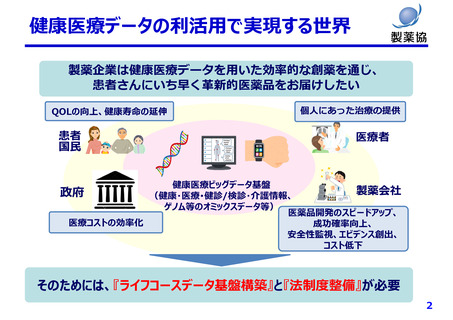
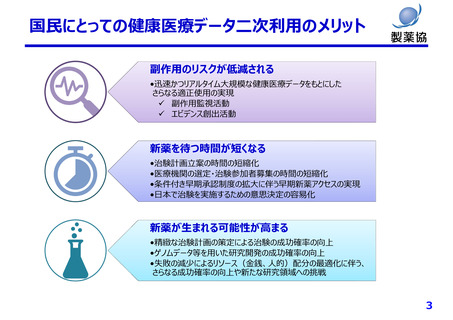
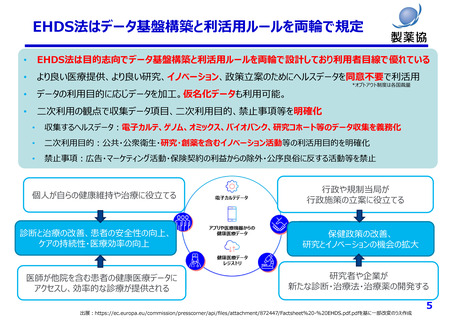
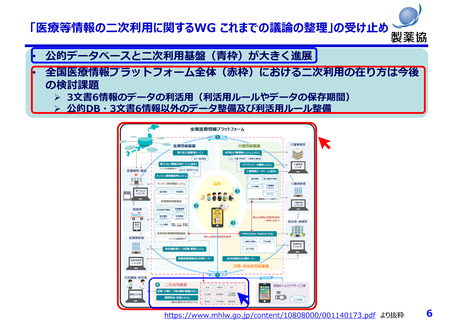
個⼈情報保護制度の課題(⼀例)
匿名加⼯は医療分野の研究開発に馴染まず、仮名化が望ましい
• データの真正性が担保できず薬事申請等の利活⽤が困難
• 症状等の追加情報収集や経時的追跡が不可能
• 希少な症例や外れ値の活⽤ができない
• ゲノムデータは匿名加⼯、仮名加⼯できない(個⼈識別符号のため)
• 次世代医療基盤法の「丁寧なオプトアウト」は通常の同意取得と⼤差なく医療機関の負担⼤
• 次世代医療基盤法では、認定された⺠間事業者が⾃らデータ収集をする取り組みであり、全⼈⼝をカバーするデータ基
盤になる⾒込みはない
本⼈同意の困難性
• 同意説明と取得を⾏う医療機関の⼿間や⼿続き等の負担は⾮常に⼤きい
• 将来のために情報を蓄積する場合(レジストリ、バイオバンク等)同意取得時点で詳細な説明が困難
• 製薬企業はグローバルに活動しており、令和2年改正法による外国への第三者への提供に関する説明事項の増加が⼤
きな負担
その他
• 公衆衛⽣例外規定では⾰新的な医薬品の研究⽬的(開発は対象外)のみしか活⽤できず限定的
• 個⼈情報保護法や医学系倫理指針が複雑であり、研究者、倫理審査委員会関係者、国⺠にとって理解困難
• 医薬品開発は10年以上要するが、その間も個情法は3年毎に⾒直される。過去に取得したデータが利⽤できなくならない
よう、適切な経過措置や予⾒性が必要
16
匿名加⼯は医療分野の研究開発に馴染まず、仮名化が望ましい
• データの真正性が担保できず薬事申請等の利活⽤が困難
• 症状等の追加情報収集や経時的追跡が不可能
• 希少な症例や外れ値の活⽤ができない
• ゲノムデータは匿名加⼯、仮名加⼯できない(個⼈識別符号のため)
• 次世代医療基盤法の「丁寧なオプトアウト」は通常の同意取得と⼤差なく医療機関の負担⼤
• 次世代医療基盤法では、認定された⺠間事業者が⾃らデータ収集をする取り組みであり、全⼈⼝をカバーするデータ基
盤になる⾒込みはない
本⼈同意の困難性
• 同意説明と取得を⾏う医療機関の⼿間や⼿続き等の負担は⾮常に⼤きい
• 将来のために情報を蓄積する場合(レジストリ、バイオバンク等)同意取得時点で詳細な説明が困難
• 製薬企業はグローバルに活動しており、令和2年改正法による外国への第三者への提供に関する説明事項の増加が⼤
きな負担
その他
• 公衆衛⽣例外規定では⾰新的な医薬品の研究⽬的(開発は対象外)のみしか活⽤できず限定的
• 個⼈情報保護法や医学系倫理指針が複雑であり、研究者、倫理審査委員会関係者、国⺠にとって理解困難
• 医薬品開発は10年以上要するが、その間も個情法は3年毎に⾒直される。過去に取得したデータが利⽤できなくならない
よう、適切な経過措置や予⾒性が必要
16