資 料3-3 令和4年度第3回安全技術調査会の審議結果について (75 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29732.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会運営委員会(令和4年度第3回 12/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
① 献⾎者の安全性確保の観点
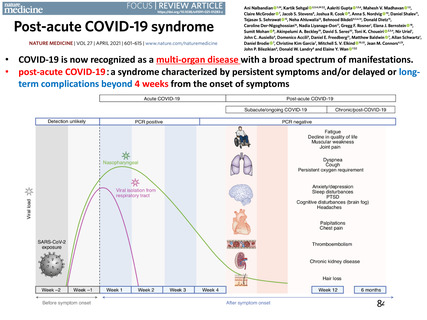
I. 「新型コロナウイルス感染症(COVID-19)診療の⼿引き(第5版)」における「退院職場復帰基準」が、『発症⽇(無
症候の場合は陽性となった検査の検体採取⽇)から10⽇間経過し、かつ症状軽快後72時間経過すること』と設定されて
いることを考慮し、症状消失(無症候の場合は陽性となった検査の検体採取⽇)から2週間の採⾎制限期間を設ける
とともに、献⾎者の安全性への更なる配慮を⽬的として、2週間の期間を追加した計4週間の採⾎制限期間を設定する
ことにより、献⾎者の安全性をより保守的に⾒積もることが可能であること。
II. 以下の点を踏まえると、現在、献⾎時に⼀般的に⾏われている健康診断に加え、献⾎に不適切と考えられる後遺症の有
無等に係る問診や、必要時に動脈⾎酸素飽和度を測定する等の健康診断を追加で実施することにより、献⾎者の安全
性を確保することが可能であると考えられたこと。
② 採⾎所における感染拡⼤防⽌の観点
新型コロナウイルス感染症については、再陽性者が認められることや、発症後4週間を超えて咽頭ぬぐい液によるPCR検査が陽
性となる例が知られているものの、以下の点(注︓再陽性者や発症後10⽇以降の症例については感染性のウイルスが認めら
れない)を踏まえると、症状消失後4週間の採⾎制限期間を設けることにより、採⾎所におけるクラスターの発⽣を抑制できる
と考えられること。
③ ⾎液製剤の安全性の観点
新型コロナウイルス既感染者から採⾎した⾎液において、RNAaeminaを認めた場合に、当該⾎液から製造された⾎液製剤につ
いて感染性があったとの⽂献報告はないこと。
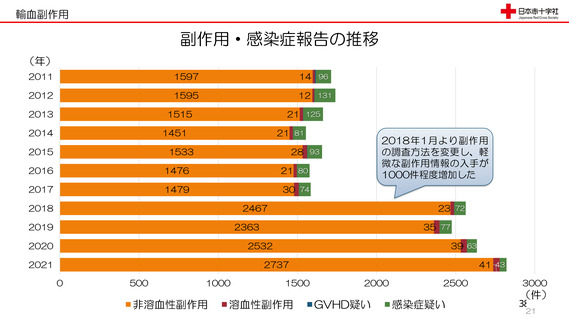
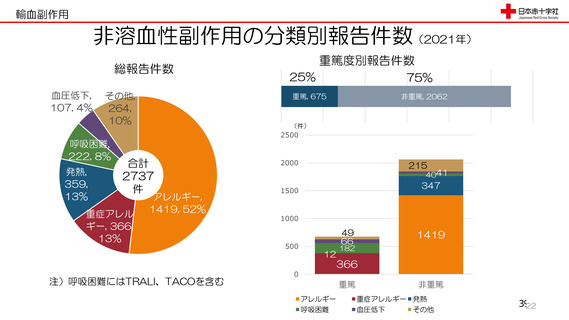
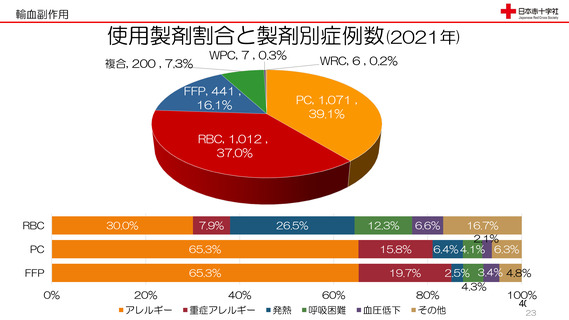
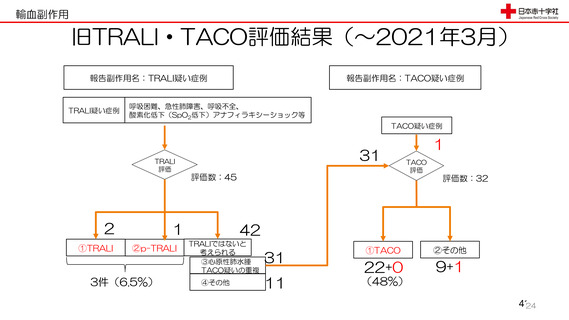
令和3年度第2回安全技術調査会資料より抜粋
2
72