よむ、つかう、まなぶ。
【資料1】テーマ①(ドラッグロスや供給不足などの医薬品等へのアクセスの課題に対応した安全かつ迅速な承認制度の確立)について.pdf (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40580.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第3回 6/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
テーマ①:ドラッグロスや供給不足などの医薬品等へのアクセスの課題に対応した安
全かつ迅速な承認制度の確立
背景・課題
•
近年、創薬環境の変化に伴い、日本では医薬品の開発に着手されないドラッグロス問題が拡大していると
指摘されており、薬事制度の観点からもアクセス向上の検討が必要。
•
医薬品の供給逼迫が生じた際、現行のスキームでは、既承認製品の製造方法の変更に海外と比べて時間が
かかる。
(※)運用上の課題を含め、昨年7月から「創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会」において検討を
進め、本年4月に報告書を公表した。
ご議論いただきたい事項
(1)小児用医薬品のドラッグロス解消に向けた制度的対応
(小児用医薬品開発の計画策定の努力義務化、小児用医薬品等の特定用途医薬品に係る制度の見直し等)
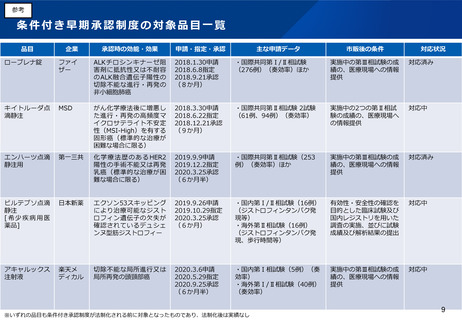
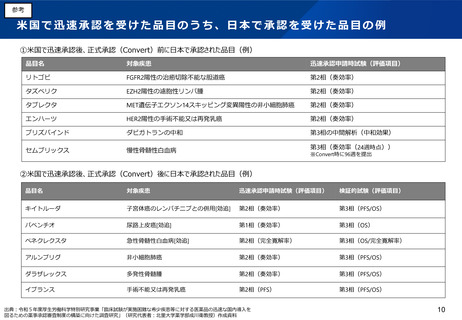
(2)医療上の必要性の高い医薬品への早期アクセスの確保(条件付き早期承認制度の見直し等)
(3)リアルワールドデータ(RWD)を利活用した薬事申請対応の充実強化
(4)医薬品等の供給不足を踏まえたアクセス改善に向けた制度の見直し
(海外代替品等の迅速な導入の仕組み、製造方法等の中リスクの変更カテゴリの追加)
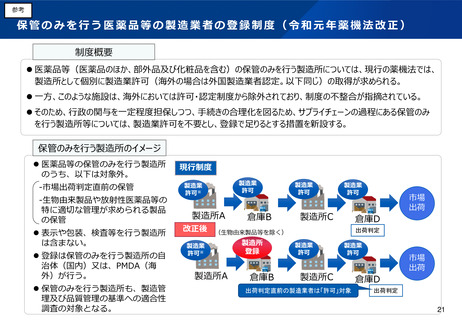
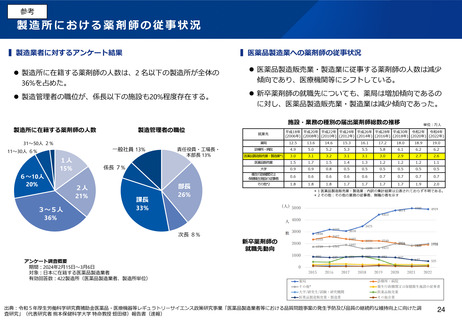
(5)医薬品製造業における許可制度(管理者の要件を含む)の見直し
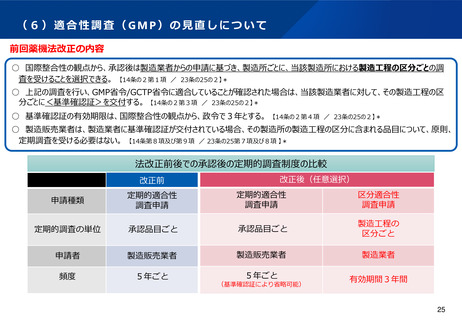
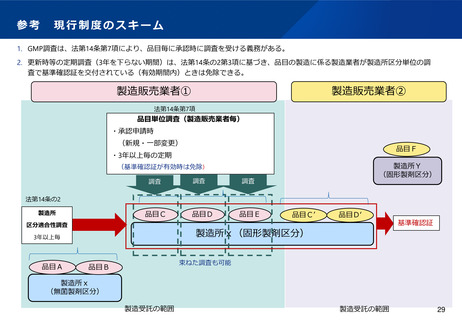
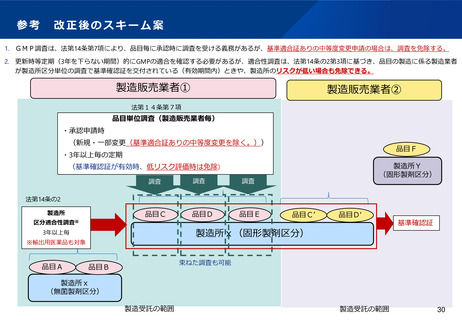
(6)適合性調査の見直し
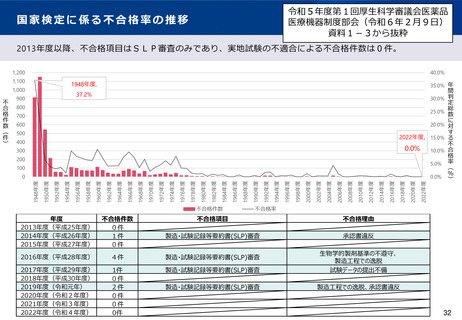
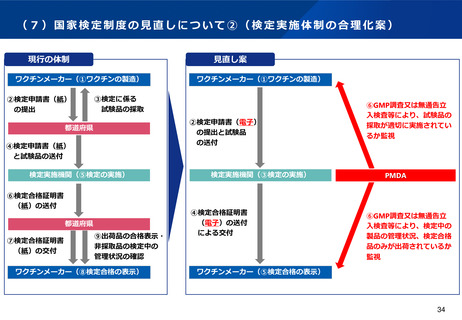
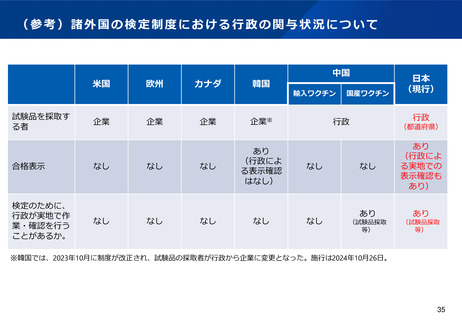
(7)国家検定の見直しや都道府県経由事務等の廃止
(8)再生医療等製品の特性を踏まえた治療アクセスの改善
※ 第1回医薬品医療機器制度部会 資料2-1を一部改変 2
全かつ迅速な承認制度の確立
背景・課題
•
近年、創薬環境の変化に伴い、日本では医薬品の開発に着手されないドラッグロス問題が拡大していると
指摘されており、薬事制度の観点からもアクセス向上の検討が必要。
•
医薬品の供給逼迫が生じた際、現行のスキームでは、既承認製品の製造方法の変更に海外と比べて時間が
かかる。
(※)運用上の課題を含め、昨年7月から「創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会」において検討を
進め、本年4月に報告書を公表した。
ご議論いただきたい事項
(1)小児用医薬品のドラッグロス解消に向けた制度的対応
(小児用医薬品開発の計画策定の努力義務化、小児用医薬品等の特定用途医薬品に係る制度の見直し等)
(2)医療上の必要性の高い医薬品への早期アクセスの確保(条件付き早期承認制度の見直し等)
(3)リアルワールドデータ(RWD)を利活用した薬事申請対応の充実強化
(4)医薬品等の供給不足を踏まえたアクセス改善に向けた制度の見直し
(海外代替品等の迅速な導入の仕組み、製造方法等の中リスクの変更カテゴリの追加)
(5)医薬品製造業における許可制度(管理者の要件を含む)の見直し
(6)適合性調査の見直し
(7)国家検定の見直しや都道府県経由事務等の廃止
(8)再生医療等製品の特性を踏まえた治療アクセスの改善
※ 第1回医薬品医療機器制度部会 資料2-1を一部改変 2