よむ、つかう、まなぶ。
【資料1】テーマ①(ドラッグロスや供給不足などの医薬品等へのアクセスの課題に対応した安全かつ迅速な承認制度の確立)について.pdf (38 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40580.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第3回 6/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
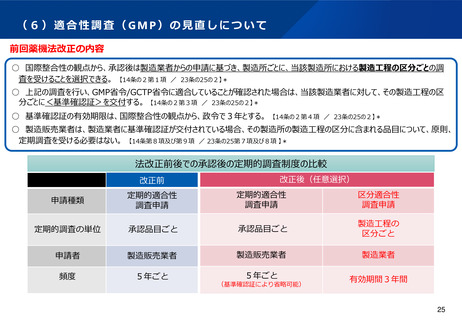
(参考)自家細胞を用いた再生医療等製品の特性と課題
自家細胞を用いた再生医療等製品の製造から使用までの流れ
○患者から細胞・組織を採取し、製造施設において細胞培養等を行った上で製品化。製造には一定程度時間を要する。
○細胞等の採取から使用まで、厳格な品質管理とスケジュール管理が行われている。
【治療施設】
製造施設へ輸送
1. 細胞・組織の採取
【製造施設】
2. 細胞培養等
規格外品
患者
患者から採取された細胞・組織を原料として製造するため、患
者の全身状態や年齢、前治療歴などの影響により、規格外品が
一定数発生してしまう。
細胞・組織
の採取
規格外品
細胞培養等
治療施設へ輸送
4. 使用
3. 品質チェック
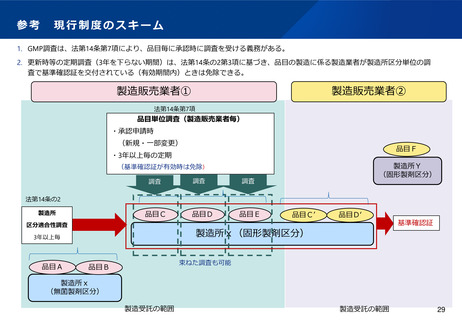
規格外品に対する医療ニーズとその課題
○規格外品の販売、授与等は原則禁止されていることから、
下記のような場合には、安全性を損なうものでなければ
使用したいという患者及び医師からの強い要望がある。
✓ 重篤な疾患であり他に有効な治療法がない。
✓ 患者の状態から、再度、細胞・組織を採取し、再製造
を待つことができない。
等
○このような場合には、治験の枠組により規格外品が治療
に用いられている。
規格外品
規格外品
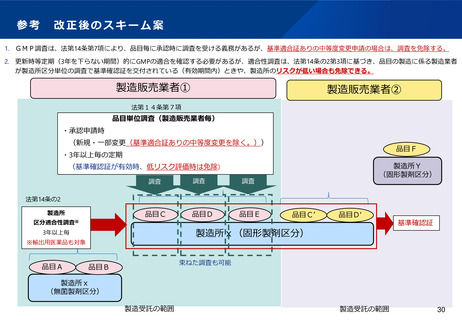
現行制度下では、
医療機関、製造販売業者、患者への負担・不利益が発生
<医療機関、製造販売業者>
➢ 規格外品の提供に備えるため、通常の治療実施体制に加え、
治験実施体制の整備・恒常的な維持が必要(人的・金銭的な
負担)。
<患者>
➢ 治験としての手続きが必要となるため、スケジュールの変
更・追加検査等が発生(治療機会の逸失に繋がる可能性) 38
自家細胞を用いた再生医療等製品の製造から使用までの流れ
○患者から細胞・組織を採取し、製造施設において細胞培養等を行った上で製品化。製造には一定程度時間を要する。
○細胞等の採取から使用まで、厳格な品質管理とスケジュール管理が行われている。
【治療施設】
製造施設へ輸送
1. 細胞・組織の採取
【製造施設】
2. 細胞培養等
規格外品
患者
患者から採取された細胞・組織を原料として製造するため、患
者の全身状態や年齢、前治療歴などの影響により、規格外品が
一定数発生してしまう。
細胞・組織
の採取
規格外品
細胞培養等
治療施設へ輸送
4. 使用
3. 品質チェック
規格外品に対する医療ニーズとその課題
○規格外品の販売、授与等は原則禁止されていることから、
下記のような場合には、安全性を損なうものでなければ
使用したいという患者及び医師からの強い要望がある。
✓ 重篤な疾患であり他に有効な治療法がない。
✓ 患者の状態から、再度、細胞・組織を採取し、再製造
を待つことができない。
等
○このような場合には、治験の枠組により規格外品が治療
に用いられている。
規格外品
規格外品
現行制度下では、
医療機関、製造販売業者、患者への負担・不利益が発生
<医療機関、製造販売業者>
➢ 規格外品の提供に備えるため、通常の治療実施体制に加え、
治験実施体制の整備・恒常的な維持が必要(人的・金銭的な
負担)。
<患者>
➢ 治験としての手続きが必要となるため、スケジュールの変
更・追加検査等が発生(治療機会の逸失に繋がる可能性) 38