よむ、つかう、まなぶ。
【資料1】テーマ①(ドラッグロスや供給不足などの医薬品等へのアクセスの課題に対応した安全かつ迅速な承認制度の確立)について.pdf (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40580.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第3回 6/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
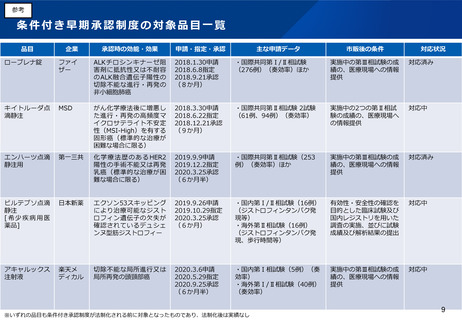
(2)医療上の必要性の高い医薬品への早期アクセスの確保
背景・課題
•
医療上の必要性の高い希少・重篤な疾患に対する医薬品については、検証的試験※の結果を待たず、探索的な試験(いわゆる第Ⅱ
相までの試験)結果に基づいて薬事承認を行う制度が、日米欧において設けられている。
※ 医薬品の有効性及び安全性を検証するための試験であり、そのデザインは医薬品ごとに異なる。いわゆる第Ⅲ相試験。
•
しかしながら、日本の条件付き承認制度は、承認の取り消し規定がないため、明らかな効果が確認できた探索的試験(第Ⅱ相試
験)の結果に基づく場合や、検証的試験の実施途中である場合の適用を想定したものとなっている。そのため、日本においては、
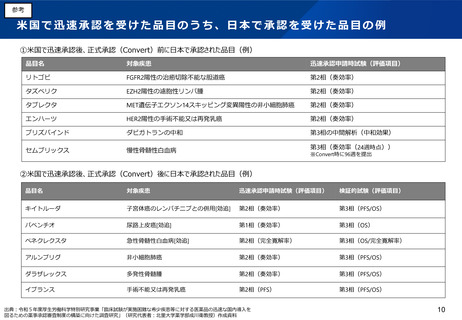
米国のAccelerated Approval(迅速承認)や EUの Conditional Approval のような、探索的な試験結果であっても有効性が期待
できると合理的に判断された状況であれば早期に適用される仕組みと比べて、制度創設後の承認件数が少ない。こうした状況を背
景に、製薬業界やベンチャー企業、患者団体等より、その運用の拡大を求める声がある。
•
これを踏まえ、「創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会」において検討を行い、現行の条件
付き承認制度について、適応要件を柔軟に解釈できるよう運用を見直すことなどの対応をすることとしているが、あわせて、制度
的枠組みのあり方については、別途検討を進めることとされた。
検討の方向性(案)
•
我が国においても、欧米と同様に、取り消し規定を設けた上で、探索的試験の段階で医薬品を早期に承認するベネフィットが、検
証的試験が必要であることによるリスクを上回るものに対して、その臨床的有用性が合理的に予測可能な場合に、承認を与える制
度を検討してはどうか。
•
あわせて、海外で承認済み等の医薬品について、国内では極めて患者数が少ない等の理由で薬事承認を受けるための臨床開発を行
うことが現実的ではない医薬品の輸入や患者申出療養などの手続きが煩雑であり、迅速なアクセスの支障となっていることから、
米国のsingle patient INDを参考に、拡大治験を包括的に見直すなど、より簡略な仕組みを構築できないか。(医療側のIRB (治
験審査委員会)などの受け入れ体制についても検討が必要。包括的な拡大治験の一環として、届出を提出できる仕組みも検討でき
ないか。)
6
背景・課題
•
医療上の必要性の高い希少・重篤な疾患に対する医薬品については、検証的試験※の結果を待たず、探索的な試験(いわゆる第Ⅱ
相までの試験)結果に基づいて薬事承認を行う制度が、日米欧において設けられている。
※ 医薬品の有効性及び安全性を検証するための試験であり、そのデザインは医薬品ごとに異なる。いわゆる第Ⅲ相試験。
•
しかしながら、日本の条件付き承認制度は、承認の取り消し規定がないため、明らかな効果が確認できた探索的試験(第Ⅱ相試
験)の結果に基づく場合や、検証的試験の実施途中である場合の適用を想定したものとなっている。そのため、日本においては、
米国のAccelerated Approval(迅速承認)や EUの Conditional Approval のような、探索的な試験結果であっても有効性が期待
できると合理的に判断された状況であれば早期に適用される仕組みと比べて、制度創設後の承認件数が少ない。こうした状況を背
景に、製薬業界やベンチャー企業、患者団体等より、その運用の拡大を求める声がある。
•
これを踏まえ、「創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会」において検討を行い、現行の条件
付き承認制度について、適応要件を柔軟に解釈できるよう運用を見直すことなどの対応をすることとしているが、あわせて、制度
的枠組みのあり方については、別途検討を進めることとされた。
検討の方向性(案)
•
我が国においても、欧米と同様に、取り消し規定を設けた上で、探索的試験の段階で医薬品を早期に承認するベネフィットが、検
証的試験が必要であることによるリスクを上回るものに対して、その臨床的有用性が合理的に予測可能な場合に、承認を与える制
度を検討してはどうか。
•
あわせて、海外で承認済み等の医薬品について、国内では極めて患者数が少ない等の理由で薬事承認を受けるための臨床開発を行
うことが現実的ではない医薬品の輸入や患者申出療養などの手続きが煩雑であり、迅速なアクセスの支障となっていることから、
米国のsingle patient INDを参考に、拡大治験を包括的に見直すなど、より簡略な仕組みを構築できないか。(医療側のIRB (治
験審査委員会)などの受け入れ体制についても検討が必要。包括的な拡大治験の一環として、届出を提出できる仕組みも検討でき
ないか。)
6