よむ、つかう、まなぶ。
【資料1】テーマ①(ドラッグロスや供給不足などの医薬品等へのアクセスの課題に対応した安全かつ迅速な承認制度の確立)について.pdf (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40580.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第3回 6/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
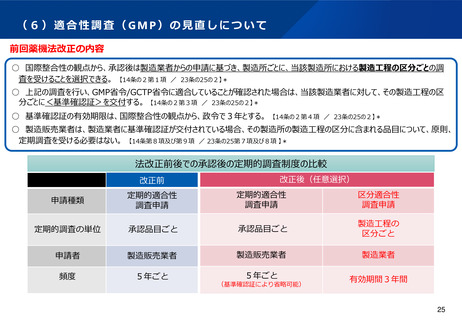
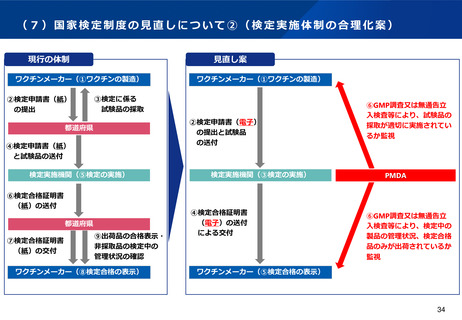
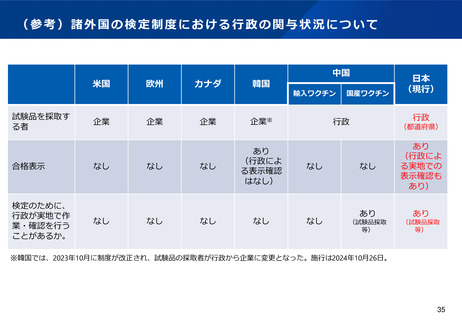
(6)適合性調査(GMP)の見直しについて
前回薬機法改正の内容
○ 国際整合性の観点から、承認後は製造業者からの申請に基づき、製造所ごとに、当該製造所における製造工程の区分ごとの調
査を受けることを選択できる。 【14条の2第1項 / 23条の25の2】*
○ 上記の調査を行い、GMP省令/GCTP省令に適合していることが確認された場合は、当該製造業者に対して、その製造工程の区
分ごとに<基準確認証>を交付する。 【14条の2第3項 / 23条の25の2】*
○ 基準確認証の有効期限は、国際整合性の観点から、政令で3年とする。 【14条の2第4項 / 23条の25の2】*
○ 製造販売業者は、製造業者に基準確認証が交付されている場合、その製造所の製造工程の区分に含まれる品目について、原則、
定期調査を受ける必要はない。 【14条第8項及び第9項 / 23条の25第7項及び8項 】*
法改正前後での承認後の定期的調査制度の比較
改正後(任意選択)
改正前
申請種類
定期的適合性
調査申請
定期的適合性
調査申請
区分適合性
調査申請
定期的調査の単位
承認品目ごと
承認品目ごと
製造工程の
区分ごと
申請者
製造販売業者
製造販売業者
製造業者
頻度
5年ごと
5年ごと
有効期間3年間
(基準確認証により省略可能)
25
前回薬機法改正の内容
○ 国際整合性の観点から、承認後は製造業者からの申請に基づき、製造所ごとに、当該製造所における製造工程の区分ごとの調
査を受けることを選択できる。 【14条の2第1項 / 23条の25の2】*
○ 上記の調査を行い、GMP省令/GCTP省令に適合していることが確認された場合は、当該製造業者に対して、その製造工程の区
分ごとに<基準確認証>を交付する。 【14条の2第3項 / 23条の25の2】*
○ 基準確認証の有効期限は、国際整合性の観点から、政令で3年とする。 【14条の2第4項 / 23条の25の2】*
○ 製造販売業者は、製造業者に基準確認証が交付されている場合、その製造所の製造工程の区分に含まれる品目について、原則、
定期調査を受ける必要はない。 【14条第8項及び第9項 / 23条の25第7項及び8項 】*
法改正前後での承認後の定期的調査制度の比較
改正後(任意選択)
改正前
申請種類
定期的適合性
調査申請
定期的適合性
調査申請
区分適合性
調査申請
定期的調査の単位
承認品目ごと
承認品目ごと
製造工程の
区分ごと
申請者
製造販売業者
製造販売業者
製造業者
頻度
5年ごと
5年ごと
有効期間3年間
(基準確認証により省略可能)
25