よむ、つかう、まなぶ。
【資料1】テーマ①(ドラッグロスや供給不足などの医薬品等へのアクセスの課題に対応した安全かつ迅速な承認制度の確立)について.pdf (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40580.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第3回 6/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
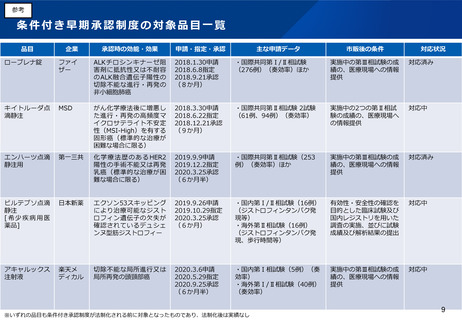
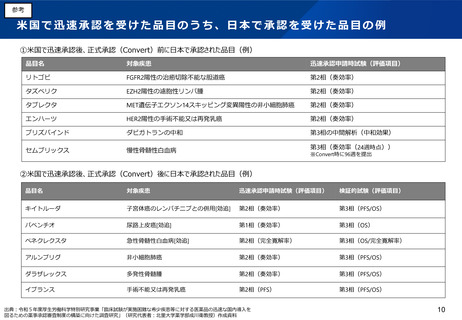
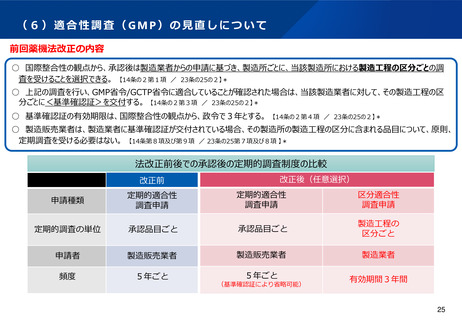
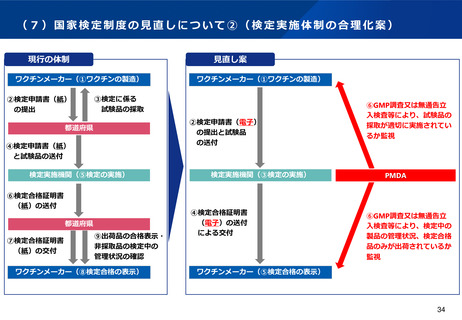
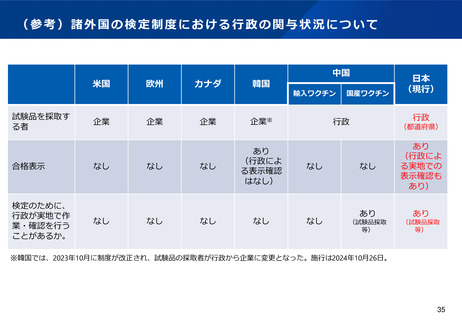
(5)医薬品製造業における許可制度の見直し
背景・課題
•
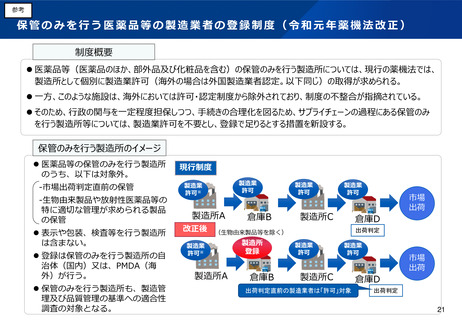
令和元年の薬機法改正において、サプライチェーンの過程にある保管のみを行う製造所等については、許可・認定は不要とし、登録制とする
こととされた。ただし、市場出荷判定直前の保管や、生物由来製品や放射性医薬品等の特に適切な管理が求められる製品の保管を行う製造所
については、除外されていた。
•
令和元年の改正以降の実績や、国際整合の観点を踏まえ、生物由来製品や放射性医薬品等の保管のみを行う製造所や、海外製造所について、
許可・認定ではなく登録制とし、手続きの合理化を図る必要性が指摘されている。
•
また、複雑化するグローバルサプライチェーンにおいて、保管のみを行う製造所は数多く存在することから、その全てを製造方法として承認
申請書に記載し、変更のたびに薬事手続きが必要であることについても、供給量の変動に迅速に対応できないといった課題が指摘されている。
•
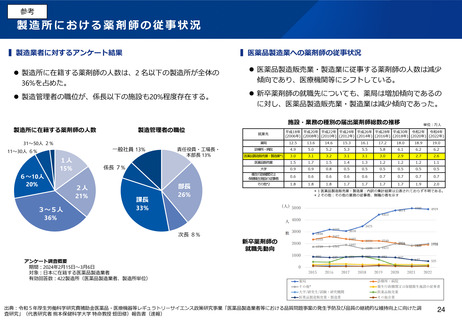
加えて、製造所における製造管理者の要件について、原則として薬剤師を置く必要がある点について、見直しを求める意見がある。
検討の方向性(案)
製造所の登録制度の拡大
⚫
生物由来製品や放射性医薬品等の保管のみを行う製造所につい
て、他の製造所と同様に登録制としてはどうか(市場出荷判定
を行う製造所は除く) 。
⚫
また、海外製造所については、認定制ではなく、登録制として
はどうか。
⚫
承認書における製造方法において、保管のみを行う海外製造所
については、記載を不要としてはどうか。ただし、製品の移動
に係る記録は適切に保管するものとする。
製造管理者の要件の見直し
⚫
製造所における製造管理者について、薬剤師以外の者が担える
よう、要件の見直しを行うことについて、どう考えるか。
20
背景・課題
•
令和元年の薬機法改正において、サプライチェーンの過程にある保管のみを行う製造所等については、許可・認定は不要とし、登録制とする
こととされた。ただし、市場出荷判定直前の保管や、生物由来製品や放射性医薬品等の特に適切な管理が求められる製品の保管を行う製造所
については、除外されていた。
•
令和元年の改正以降の実績や、国際整合の観点を踏まえ、生物由来製品や放射性医薬品等の保管のみを行う製造所や、海外製造所について、
許可・認定ではなく登録制とし、手続きの合理化を図る必要性が指摘されている。
•
また、複雑化するグローバルサプライチェーンにおいて、保管のみを行う製造所は数多く存在することから、その全てを製造方法として承認
申請書に記載し、変更のたびに薬事手続きが必要であることについても、供給量の変動に迅速に対応できないといった課題が指摘されている。
•
加えて、製造所における製造管理者の要件について、原則として薬剤師を置く必要がある点について、見直しを求める意見がある。
検討の方向性(案)
製造所の登録制度の拡大
⚫
生物由来製品や放射性医薬品等の保管のみを行う製造所につい
て、他の製造所と同様に登録制としてはどうか(市場出荷判定
を行う製造所は除く) 。
⚫
また、海外製造所については、認定制ではなく、登録制として
はどうか。
⚫
承認書における製造方法において、保管のみを行う海外製造所
については、記載を不要としてはどうか。ただし、製品の移動
に係る記録は適切に保管するものとする。
製造管理者の要件の見直し
⚫
製造所における製造管理者について、薬剤師以外の者が担える
よう、要件の見直しを行うことについて、どう考えるか。
20