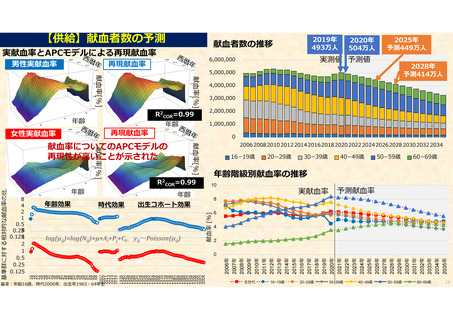
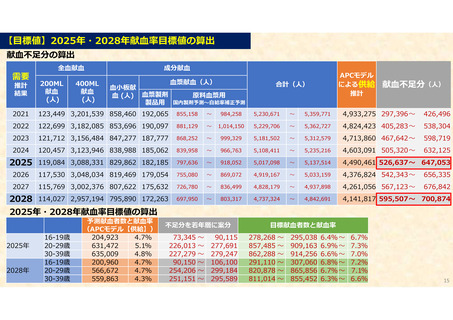
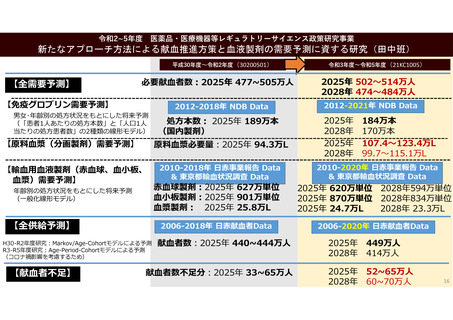
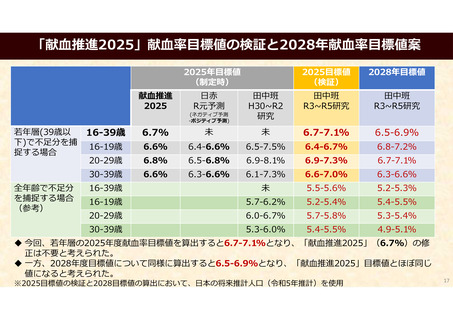
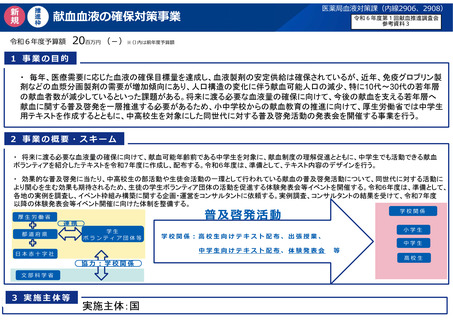
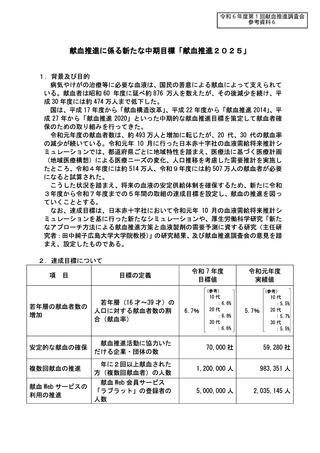
資 料 4 令和6年度第1回献血推進調査会の概要について (101 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42777.html |
| 出典情報 | 薬事審議会 血液事業部会 安全技術調査会(令和6年度第1回 8/30)、運営委員会(第2回 8/30)(合同会議)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
保が求められている。
1
保健衛生上の観点から定める原料等及び品質等に関する基準(生物由来原料
基準(平成十五年厚生労働省告示第二百十号)及び生物学的製剤基準(平成十
六年厚生労働省告示第百五十五号))
2
構造設備、製造管理及び品質管理の方法について、その特性に応じた基準(薬
局等構造設備規則(昭和三十六年厚生省令第二号)第八条、医薬品及び医薬部
外品の製造管理及び品質管理の基準に関する省令(平成十六年厚生労働省令第
百七十九号)第二十八条)
3
直接の容器又は直接の被包等において、感染のリスク等を有することから適
正に使用すべき医薬品等であることを明らかにするため、安全性の確保に関し
必要な表示を行うこと(医薬品医療機器等法第六十八条の十七)。
4
病原体の混入が判明した場合に遡及調査を速やかに講ずることを可能とす
るため、製造販売業者、販売業者及び医療関係者は必要な事項について記録を
作成し、保存すること(医薬品医療機器等法第六十八条の二十二)。また、製造
業者は、特定生物由来製品について、遡及調査のために必要な量を、他の医薬
品等と比べてより長期間、適切に保存すること(医薬品及び医薬部外品の製造
管理及び品質管理の基準に関する省令第二十八条)。
5
生物由来製品の製造販売業者又は外国製造医薬品等特例承認取得者は、その
製造販売をし、又は承認を受けた生物由来製品又は当該生物由来製品の原料に
よる感染症に関する最新の知見に基づき当該生物由来製品を評価し、その成果
について、厚生労働大臣に感染症定期報告を行わなければならないこと(医薬
品医療機器等法第六十八条の二十四第一項)。
6
厚生労働大臣は、感染症定期報告に係る情報の整理又は調査を行った上で、
当該感染症定期報告の状況について審議会に報告し、必要があると認めるとき
は、その意見を聴いて、保健衛生上の危害の発生又は拡大を防止するために必
要な措置を講ずること(医薬品医療機器等法第六十八条の二十四第二項及び第
三項)。特に、血液製剤については、これらの措置に加えて、採血事業者に対す
る指示その他血液製剤の安全性の向上のために必要な措置を講ずること(法第
三十条)。
7
医療関係者は、特定生物由来製品の有効性及び安全性その他当該製品の適正
な使用のために必要な事項について、患者等に対し、適切な説明を行い、その
理解を得るよう努めること(医薬品医療機器等法第六十八条の二十一)。
以上の基準等とともに、血液製剤の一層の安全性の確保を図るため、国、地方
公共団体及び採血事業者は、献血者に対し、検査を目的とした献血を行わないよ
12
100