よむ、つかう、まなぶ。
【資料1-3】承認基準改正案 (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28311.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第6回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
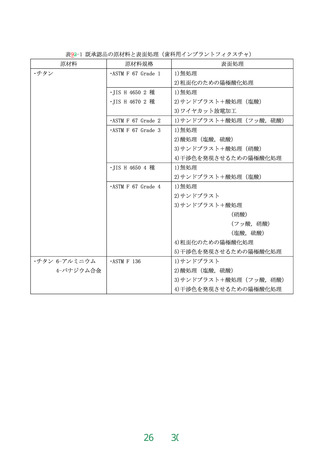
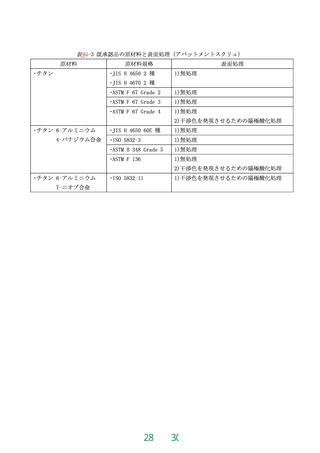
JIS T 3250 の 4.1「生物学的安全性」による。
7 性能に関する要求事項
JIS T 3250 の 4.5.2「血液透析ろ過器,血液ろ過器及び血液濃縮器のふるい係数」
、4.5.3「限外ろ過
率」
、4.5.4「血液側容量(充塡量)
」及び 4.5.5「血液側の圧力損失」による。
なお、性能特性の同等性は、同一膜面積(膜面積換算値を含む。
)の既承認品目を比較対照として、
JIS T 3250 に示された試験により、以下の基準を用いて適合性を判断するものとする。
JIS T 3250 の 4.5.3 による限外濾過率(mL/hr/mmHgmL/mmHg/h)の違いが 25%以下であり、かつ、
JIS T 3250 の 4.5.2 によるアルブミン、イヌリン及びβ2-ミクログロブリン又はミオグロビンのふる
い係数の違いが 50%以下である場合には同等とみなす。なお、測定に際しては、50, 300 及び 500
mL/min の血液流量にて測定を行うこととする。
8 安定性に関する要求事項
最終包装の滅菌済み血液濃縮器の使用期限は、JIS T 3250 の 4.6「使用期限」による。
9 無菌性の保証
「滅菌バリデーション基準」又はこれと同等以上の基準に基づき、無菌性の担保を図ること。
10 エチレンオキサイド滅菌における滅菌残留物試験
エチレンオキサイド滅菌を行った血液濃縮器は、JIS T 0993-7 に適合しなければならない。
11 包装
11.1 一次包装
一次包装は、使用前に容易に破損及びピンホールを生ずる破れるおそれがなく、微生物の侵入
を防止することができ、通常の取扱い、輸送、及び保管中に内容製品を適切に保護できるもので
あることに損傷のおそれがないように包装する。
一次包装で無菌性を保証する製品の一次包装は、微生物の侵入を防止することができるもので
あること。また、一度開封したら、包装は簡単に再シールできず、開封されたことが明確に分か
るものとする。
11.2 二次包装
二次包装は、取扱い、輸送、保管中に内容製品及び一次包装を適切に保護できるものであるこ
と。
12 表示
薬事法医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和 35 年法律第 145
号)
(以下、
「法」という。
)で求められる表示事項に加え、本体、一次包装及び二次包装に対して、JIS
T 3250 の 6.1「本体の表示」
、6.2「一次包装(該当機器の個包装)
」及び 6.3「二次包装(外箱)
」の事
項を表示すること。但し、次の事項が薬事法の記載事項と重複する場合にはこの限りではない。なお、
海外で製造されるもの等であって、国内で邦文を表示する製品においては、JIS T 3250 の 6.1 に規定さ
れている本体に表示するべき事項のうち、
「製造販売業者の規定する該当機器の識別コード」及び「ロ
ット番号」以外は、一次包装に表示することで差し支えないものとする。
11 / 30
7 性能に関する要求事項
JIS T 3250 の 4.5.2「血液透析ろ過器,血液ろ過器及び血液濃縮器のふるい係数」
、4.5.3「限外ろ過
率」
、4.5.4「血液側容量(充塡量)
」及び 4.5.5「血液側の圧力損失」による。
なお、性能特性の同等性は、同一膜面積(膜面積換算値を含む。
)の既承認品目を比較対照として、
JIS T 3250 に示された試験により、以下の基準を用いて適合性を判断するものとする。
JIS T 3250 の 4.5.3 による限外濾過率(mL/hr/mmHgmL/mmHg/h)の違いが 25%以下であり、かつ、
JIS T 3250 の 4.5.2 によるアルブミン、イヌリン及びβ2-ミクログロブリン又はミオグロビンのふる
い係数の違いが 50%以下である場合には同等とみなす。なお、測定に際しては、50, 300 及び 500
mL/min の血液流量にて測定を行うこととする。
8 安定性に関する要求事項
最終包装の滅菌済み血液濃縮器の使用期限は、JIS T 3250 の 4.6「使用期限」による。
9 無菌性の保証
「滅菌バリデーション基準」又はこれと同等以上の基準に基づき、無菌性の担保を図ること。
10 エチレンオキサイド滅菌における滅菌残留物試験
エチレンオキサイド滅菌を行った血液濃縮器は、JIS T 0993-7 に適合しなければならない。
11 包装
11.1 一次包装
一次包装は、使用前に容易に破損及びピンホールを生ずる破れるおそれがなく、微生物の侵入
を防止することができ、通常の取扱い、輸送、及び保管中に内容製品を適切に保護できるもので
あることに損傷のおそれがないように包装する。
一次包装で無菌性を保証する製品の一次包装は、微生物の侵入を防止することができるもので
あること。また、一度開封したら、包装は簡単に再シールできず、開封されたことが明確に分か
るものとする。
11.2 二次包装
二次包装は、取扱い、輸送、保管中に内容製品及び一次包装を適切に保護できるものであるこ
と。
12 表示
薬事法医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和 35 年法律第 145
号)
(以下、
「法」という。
)で求められる表示事項に加え、本体、一次包装及び二次包装に対して、JIS
T 3250 の 6.1「本体の表示」
、6.2「一次包装(該当機器の個包装)
」及び 6.3「二次包装(外箱)
」の事
項を表示すること。但し、次の事項が薬事法の記載事項と重複する場合にはこの限りではない。なお、
海外で製造されるもの等であって、国内で邦文を表示する製品においては、JIS T 3250 の 6.1 に規定さ
れている本体に表示するべき事項のうち、
「製造販売業者の規定する該当機器の識別コード」及び「ロ
ット番号」以外は、一次包装に表示することで差し支えないものとする。
11 / 30