よむ、つかう、まなぶ。
【資料1-3】承認基準改正案 (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28311.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第6回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
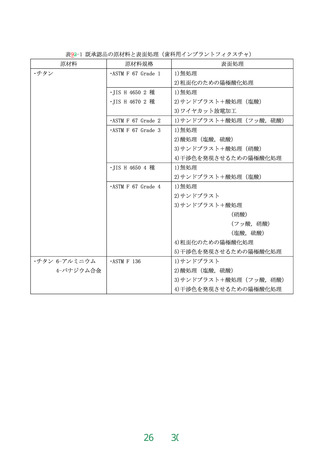
骨内埋入部最大直径(A)
全長(B)
3.0 ~ 6.0 mm
3.0 ~ 7.0 mm
13.5 ~ 23.8 mm
6.0 ~ 22.0 mm
ただし、2 ピースタイプのうち、骨内埋入部最大直径が3.8 mm 未満であり、かつ、全長
が6.25 mm 未満のものを除く。
(a)
(b)
(c)
2 ピースタイプ〔(a), (b):スクリュ型, (c):シリンダ型〕
歯科用インプラントアバットメント
1 ピースタイプ(スクリュ型)
図1 骨内埋入部最大直径(A)、全長(B) 、及び各主軸のなす角度(C)の指示箇所
c)組合せ
歯科用インプラントフィクスチャ、歯科用骨内インプラント材及び歯科用インプラントアバット
メントについては、寸法及びその規格値を記した図面(嵌合部分を含む。)を示し、組み合わせ
て用いるものについては、推奨する組合せ、及び組合せに関わる境界部分、ねじ等の寸法、又は
規格を一覧表等で示す。組合せの嵌合にがたつきがなく、滑らかでなければならない。また、歯
科用インプラントアバットメントについては各用途を記載する。
5.4.4 物理的・化学的性質要求事項
歯科用インプラントを構成する各部品の安全性、有効性を確認するために、下記の項目について試
験を行うか、又は情報を示す。試料としては、最終製品若しくは最終製品と同一の条件で作製された
試験体又は原材料を適宜使用する。ただし、承認前例のある原材料に対応する公的規格の中に規格
値がある場合には、その規格の番号、種類記号及び当該規格値を示すことで試験結果に代えること
ができる。試験方法等を変更した場合には、試験法及び試験法選択の妥当性を示す。
評価に当たっては、平成19年8月31日付け薬食機発第0831002号「歯科材料の製造販売承認申請等に
必要な物理的・化学的及び生物学的試験の基本的考え方について」の別添1「歯科材料の物理的・化
学的評価の基本的考え方」平成30年6月12日付け薬生機審発0612第4号通知「歯科用医療機器の製造販
売承認申請等に必要な生物学的安全性評価の基本的考え方等の一部改正について」の別添2「歯科材
料の物理的・化学的評価の基本的考え方」に準じて評価を行う。
5.1 4.4.1物理的性質要求事項
18 / 30
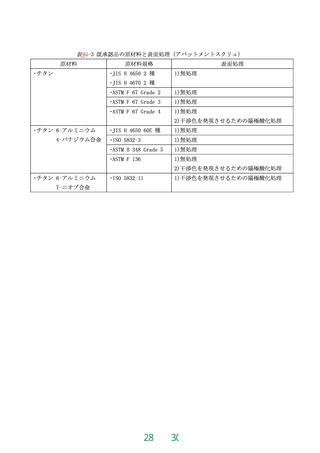
全長(B)
3.0 ~ 6.0 mm
3.0 ~ 7.0 mm
13.5 ~ 23.8 mm
6.0 ~ 22.0 mm
ただし、2 ピースタイプのうち、骨内埋入部最大直径が3.8 mm 未満であり、かつ、全長
が6.25 mm 未満のものを除く。
(a)
(b)
(c)
2 ピースタイプ〔(a), (b):スクリュ型, (c):シリンダ型〕
歯科用インプラントアバットメント
1 ピースタイプ(スクリュ型)
図1 骨内埋入部最大直径(A)、全長(B) 、及び各主軸のなす角度(C)の指示箇所
c)組合せ
歯科用インプラントフィクスチャ、歯科用骨内インプラント材及び歯科用インプラントアバット
メントについては、寸法及びその規格値を記した図面(嵌合部分を含む。)を示し、組み合わせ
て用いるものについては、推奨する組合せ、及び組合せに関わる境界部分、ねじ等の寸法、又は
規格を一覧表等で示す。組合せの嵌合にがたつきがなく、滑らかでなければならない。また、歯
科用インプラントアバットメントについては各用途を記載する。
5.4.4 物理的・化学的性質要求事項
歯科用インプラントを構成する各部品の安全性、有効性を確認するために、下記の項目について試
験を行うか、又は情報を示す。試料としては、最終製品若しくは最終製品と同一の条件で作製された
試験体又は原材料を適宜使用する。ただし、承認前例のある原材料に対応する公的規格の中に規格
値がある場合には、その規格の番号、種類記号及び当該規格値を示すことで試験結果に代えること
ができる。試験方法等を変更した場合には、試験法及び試験法選択の妥当性を示す。
評価に当たっては、平成19年8月31日付け薬食機発第0831002号「歯科材料の製造販売承認申請等に
必要な物理的・化学的及び生物学的試験の基本的考え方について」の別添1「歯科材料の物理的・化
学的評価の基本的考え方」平成30年6月12日付け薬生機審発0612第4号通知「歯科用医療機器の製造販
売承認申請等に必要な生物学的安全性評価の基本的考え方等の一部改正について」の別添2「歯科材
料の物理的・化学的評価の基本的考え方」に準じて評価を行う。
5.1 4.4.1物理的性質要求事項
18 / 30
関連画像
ページ内で利用されている画像ファイルです。
有料会員登録をして頂くことで、このページ内で利用されている画像を個別に閲覧・ダウンロードすることができるようになります。
有料会員登録のお問い合わせはこちらから。