よむ、つかう、まなぶ。
【資料1-3】承認基準改正案 (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28311.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第6回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
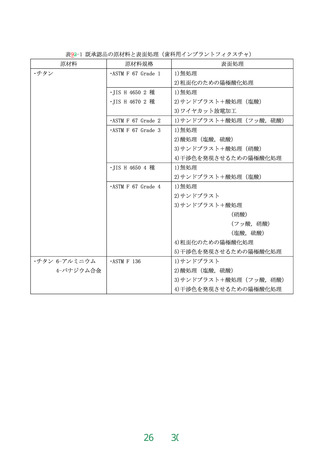
エチレンオキサイドガス滅菌された歯科用インプラントの残留ガス濃度は、「残留ガス濃度の限度
値」(平成22年10月12日付け薬食機発1012号第2号「エチレンオキサイド滅菌における滅菌残留物の許
容限度の取扱いについて」)に従う(平成10年3月31日付け医薬審第353号「エチレンオキサイドガス
滅菌における残留ガス濃度の限度値の取扱いについて」)によって、25μg/gを超えてはならない。
9.4.8リスク評価
リスク分析及びリスク評価は、歯科用インプラントフィクスチャ又は歯科用骨内インプラント材に
おける表面処理による残留物及び歯科用インプラントの疲労強度に関する点を含めてJIS T 14971
又はISO 14971 によって実施する。
10.4.9包装
a) 一次包装
一次包装は、微生物の侵入を防止することができ、通常の取扱い、輸送、保管中に製品を適
切に保護できるものであること。
b) 二次包装
二次包装は、通常の取扱い、輸送、保管中に製品及び一次包装を適切に保護できるものであ
ること。
11.4.10表示
直接の容器又は直接の被包等には、次の事項を記載(表示)しなければならない。
a) 製造販売業者の氏名又は名称及び所在地
b) 製品及び構成品の名称
c) 「滅菌済み」の旨及び滅菌方法(該当する場合)
歯科用インプラントが滅菌済み及び非滅菌の両方の状態で供給される場合には、どちらの状態で
あるかを明瞭に記載する。JIS T 0307 に規定する滅菌済み記号を使用することによってこれに替
えてもよい。
d) 製造番号又は製造記号
e) 滅菌有効期間(該当する場合)
f) 単回使用の場合には、その旨を記載する。
g) 貯蔵・保管方法(貯蔵条件及び/又は取扱い条件)
特定の貯蔵・保管方法によらなければその品質を確保することが困難であるか、又は3年以内に
経時的に品質の低下をきたす製品について、その貯蔵方法及び条件を記載する。
h) 警告及び/又は予防措置
特に注意を喚起する必要のある場合に記載する。
i) 他の法定表示事項
24 / 30
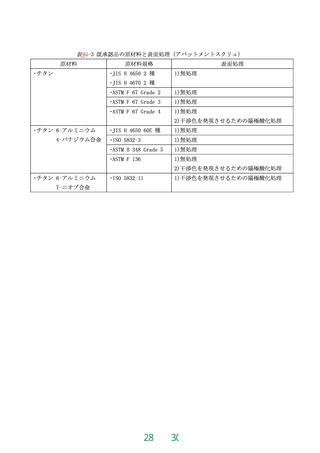
値」(平成22年10月12日付け薬食機発1012号第2号「エチレンオキサイド滅菌における滅菌残留物の許
容限度の取扱いについて」)に従う(平成10年3月31日付け医薬審第353号「エチレンオキサイドガス
滅菌における残留ガス濃度の限度値の取扱いについて」)によって、25μg/gを超えてはならない。
9.4.8リスク評価
リスク分析及びリスク評価は、歯科用インプラントフィクスチャ又は歯科用骨内インプラント材に
おける表面処理による残留物及び歯科用インプラントの疲労強度に関する点を含めてJIS T 14971
又はISO 14971 によって実施する。
10.4.9包装
a) 一次包装
一次包装は、微生物の侵入を防止することができ、通常の取扱い、輸送、保管中に製品を適
切に保護できるものであること。
b) 二次包装
二次包装は、通常の取扱い、輸送、保管中に製品及び一次包装を適切に保護できるものであ
ること。
11.4.10表示
直接の容器又は直接の被包等には、次の事項を記載(表示)しなければならない。
a) 製造販売業者の氏名又は名称及び所在地
b) 製品及び構成品の名称
c) 「滅菌済み」の旨及び滅菌方法(該当する場合)
歯科用インプラントが滅菌済み及び非滅菌の両方の状態で供給される場合には、どちらの状態で
あるかを明瞭に記載する。JIS T 0307 に規定する滅菌済み記号を使用することによってこれに替
えてもよい。
d) 製造番号又は製造記号
e) 滅菌有効期間(該当する場合)
f) 単回使用の場合には、その旨を記載する。
g) 貯蔵・保管方法(貯蔵条件及び/又は取扱い条件)
特定の貯蔵・保管方法によらなければその品質を確保することが困難であるか、又は3年以内に
経時的に品質の低下をきたす製品について、その貯蔵方法及び条件を記載する。
h) 警告及び/又は予防措置
特に注意を喚起する必要のある場合に記載する。
i) 他の法定表示事項
24 / 30