よむ、つかう、まなぶ。
【資料1-3】承認基準改正案 (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28311.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第6回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
金属材料が使用されている歯科用インプラントに適用する。各歯科用インプラントの最終製品
又は最終製品と同一条件で作製された試験体に対して、JIS T 6002:2014 の4.1 静的浸漬試験又
はISO 10271:2020 の4.1 Static immersion test に準じて溶出量の測定を行う。溶出量は、次に
よる。なお、化学成分及び表面処理に関して、既承認品との同等性を示すことができる場合にお
いては、本試験を省略することができる。
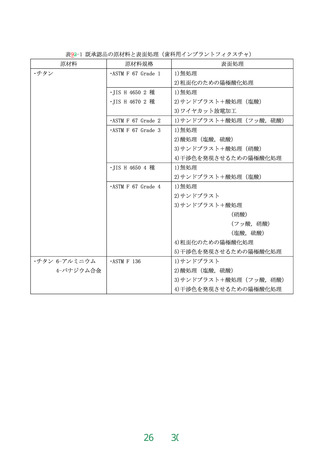
表8 耐食性(金属製の歯科用インプラント)
歯科用インプラントの種類
規格値
歯科用インプラントフィクスチャ
7日間当たりの溶出量が10μg/cm2 以下
歯科用インプラントアバットメント
7日間当たりの溶出量が20μg/cm2 以下
5.3 ハイドロキシアパタイトによるコーティング処理をされたものの物理的・化学的要求事項
歯科用インプラントのうち、ハイドロキシアパタイトによるコーティング処理をされた歯科用イ
ンプラントフィクスチャに対して、以下の1)~5)までの各項目に関して評価し、既承認品との同
等性を示す。
1)処理膜の厚さ
2)はく離強さ
3)元素分析
4)Ca/P比
5)同定・結晶化度
処理膜の厚さは、断面の顕微鏡観察によって試験する。はく離強さは、ISO 13779-4に準じて試
験を行う。元素分析及びCa/P比は、Calcium Phosphate (Ca-P) Coating Draft Guidance for
Preparation of FDA Submissions for Orthopedic and Dental Endosseous Implants、ISO137792に準じて測定を行う。同定・結晶化度は、ISO 13779-3に準じて測定を行う。
なお、評価項目及び試験方法は上記に限定されるものではなく、申請品目のコーティング方法の
種類に応じて必要な項目を追加し、既承認品との同等性を示すこと。同等性の評価にあたっては試
験の設定、選択の根拠等を示し、試験を省略する場合は、その理由、妥当性等を示すこと。
6.4.5生物学的安全性評価
歯科用インプラントの最終製品に対して、令和3年5月31日付け薬生機審発0531第5号「歯科用医療
機器の生物学的安全性評価の基本的考え方の一部改正について」の別添「歯科用医療機器の生物学的
安全性評価の基本的考え方」平成19年8月31日付け薬食機発第0831002号「歯科材料の製造販売承認申
請等に必要な物理的・化学的及び生物学的試験の基本的考え方について」の別添2「歯科用医療機器の
生物学的安全性評価の基本的考え方」に準じて、生物学的安全性評価を実施する。
7.4.6無菌性の保証
滅菌済みとして供給される歯科用インプラントは、滅菌バリデーション基準又はこれと同等以上の
基準に基づき、無菌性の担保を図る。
8.4.7残留エチレンオキサイド試験
23 / 30
又は最終製品と同一条件で作製された試験体に対して、JIS T 6002:2014 の4.1 静的浸漬試験又
はISO 10271:2020 の4.1 Static immersion test に準じて溶出量の測定を行う。溶出量は、次に
よる。なお、化学成分及び表面処理に関して、既承認品との同等性を示すことができる場合にお
いては、本試験を省略することができる。
表8 耐食性(金属製の歯科用インプラント)
歯科用インプラントの種類
規格値
歯科用インプラントフィクスチャ
7日間当たりの溶出量が10μg/cm2 以下
歯科用インプラントアバットメント
7日間当たりの溶出量が20μg/cm2 以下
5.3 ハイドロキシアパタイトによるコーティング処理をされたものの物理的・化学的要求事項
歯科用インプラントのうち、ハイドロキシアパタイトによるコーティング処理をされた歯科用イ
ンプラントフィクスチャに対して、以下の1)~5)までの各項目に関して評価し、既承認品との同
等性を示す。
1)処理膜の厚さ
2)はく離強さ
3)元素分析
4)Ca/P比
5)同定・結晶化度
処理膜の厚さは、断面の顕微鏡観察によって試験する。はく離強さは、ISO 13779-4に準じて試
験を行う。元素分析及びCa/P比は、Calcium Phosphate (Ca-P) Coating Draft Guidance for
Preparation of FDA Submissions for Orthopedic and Dental Endosseous Implants、ISO137792に準じて測定を行う。同定・結晶化度は、ISO 13779-3に準じて測定を行う。
なお、評価項目及び試験方法は上記に限定されるものではなく、申請品目のコーティング方法の
種類に応じて必要な項目を追加し、既承認品との同等性を示すこと。同等性の評価にあたっては試
験の設定、選択の根拠等を示し、試験を省略する場合は、その理由、妥当性等を示すこと。
6.4.5生物学的安全性評価
歯科用インプラントの最終製品に対して、令和3年5月31日付け薬生機審発0531第5号「歯科用医療
機器の生物学的安全性評価の基本的考え方の一部改正について」の別添「歯科用医療機器の生物学的
安全性評価の基本的考え方」平成19年8月31日付け薬食機発第0831002号「歯科材料の製造販売承認申
請等に必要な物理的・化学的及び生物学的試験の基本的考え方について」の別添2「歯科用医療機器の
生物学的安全性評価の基本的考え方」に準じて、生物学的安全性評価を実施する。
7.4.6無菌性の保証
滅菌済みとして供給される歯科用インプラントは、滅菌バリデーション基準又はこれと同等以上の
基準に基づき、無菌性の担保を図る。
8.4.7残留エチレンオキサイド試験
23 / 30