よむ、つかう、まなぶ。
【資料1-3】承認基準改正案 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28311.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第6回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添1
歯科用インプラントの製造販売承認申請に添付すべき臨床試験の
試験成績に関する資料の添付が不要の範囲
歯科用骨内インプラント材、歯科用インプラントフィクスチャ、歯科用イン
プラントシステム及び歯科用インプラントアバットメント(以下、
「歯科用イン
プラント」という。
)の製造販売承認申請に添付すべき臨床試験の試験成績に関
する資料の取扱いについては下記のとおりとする。
記
次に該当する製造販売承認申請(承認事項一部変更承認申請を含む。)の場
合には、臨床試験の試験成績に関する資料の添付は必要ないこと。
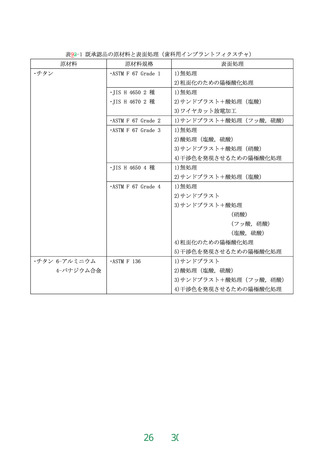
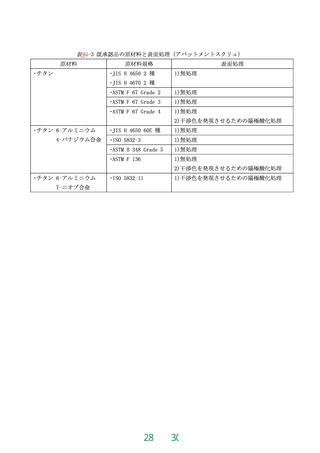
既に承認された歯科用インプラントと同一の原材料であり、かつ、既承認
品と同等の表面処理が施され、既承認品と同等の表面又は同等の表面処理の
状態をもつ歯科用インプラントの承認申請。なお、表面処理とは、サンドブ
ラスト、酸処理、サンドブラスト及び酸処理、粗面化のための陽極酸化処理、
ワイヤカット放電加工、窒化チタンによる着色処理並びに干渉色を発現させ
るための陽極酸化処理をいい、無処理も含む。ただし、骨組織に接する歯科
用インプラントにあっては、既承認品の骨組織に接する歯科用インプラント
と同一の原材料であること。
13 / 30
歯科用インプラントの製造販売承認申請に添付すべき臨床試験の
試験成績に関する資料の添付が不要の範囲
歯科用骨内インプラント材、歯科用インプラントフィクスチャ、歯科用イン
プラントシステム及び歯科用インプラントアバットメント(以下、
「歯科用イン
プラント」という。
)の製造販売承認申請に添付すべき臨床試験の試験成績に関
する資料の取扱いについては下記のとおりとする。
記
次に該当する製造販売承認申請(承認事項一部変更承認申請を含む。)の場
合には、臨床試験の試験成績に関する資料の添付は必要ないこと。
既に承認された歯科用インプラントと同一の原材料であり、かつ、既承認
品と同等の表面処理が施され、既承認品と同等の表面又は同等の表面処理の
状態をもつ歯科用インプラントの承認申請。なお、表面処理とは、サンドブ
ラスト、酸処理、サンドブラスト及び酸処理、粗面化のための陽極酸化処理、
ワイヤカット放電加工、窒化チタンによる着色処理並びに干渉色を発現させ
るための陽極酸化処理をいい、無処理も含む。ただし、骨組織に接する歯科
用インプラントにあっては、既承認品の骨組織に接する歯科用インプラント
と同一の原材料であること。
13 / 30