よむ、つかう、まなぶ。
【資料1-3】承認基準改正案 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28311.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第6回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
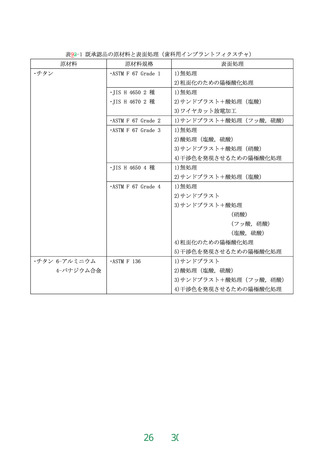
原材料によるリスクの推定
1.溶出物特性
が既存の医療
機器と異なるか
No
2.血液接触表面の
性状が既存の医
療機器と異なるか
No
血液適合性
の評価完了※
Yes
Yes
溶血性(機械的)及び血液学、必要に応じ血液凝固、血小板
活性化、補体の評価
2.血液接触表面の
性状が既存の医
療機器と異なるか
No
溶血性(材料由来)の評価
Yes
溶血性(材料由来、機械的)及び血液学、必要に応じ血液
凝固、血小板活性化、補体の評価
※既承認の血液透析器、血液濾過器又は血液透析濾過器で使用前例のある半透膜素材と同一の場
合で、且つ一般的名称が異なる場合には(例:中空糸型透析器と血液透析濾過器)、使用方法の違
いを考慮した評価を検討すること。
図1
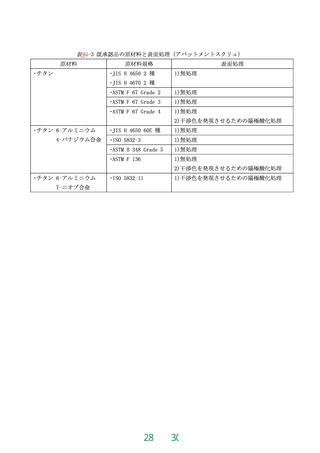
表1
血液適合性の評価の流れ
推定されるリスク要因と評価すべき項目の基本的考え方
評価カテゴリ(試験又は試験以外)※
溶血性
推定されるリスク要因
材料
由来
1.溶出物特性が既存の医療機器
と異なる
2.血液接触表面の性状が既存の
医療機器と異なる
血栓形成(in vitro)
機械的
血液
凝固
血小板
活性化
補体
血液学
●
〇
〇
〇
●
●
※:●は「評価」、〇は「必要に応じて評価」を意味しており、試験によらずとも毒性リスクが許容でき
るか否かは、ISO 10993-1、ISO 10993-18等のデシジョンツリーを用いて既存データ(自社基準を含む)によ
り総合的に判断する。各評価項目について、他の試験結果等により評価できる場合には試験不要である。
なお、推定されるリスク要因の2.については、機械的溶血性及び血液学では評価が不十分な場合には、血液
凝固、血小板活性化及び補体のうち、必要なものを評価する。
6 / 30
1.溶出物特性
が既存の医療
機器と異なるか
No
2.血液接触表面の
性状が既存の医
療機器と異なるか
No
血液適合性
の評価完了※
Yes
Yes
溶血性(機械的)及び血液学、必要に応じ血液凝固、血小板
活性化、補体の評価
2.血液接触表面の
性状が既存の医
療機器と異なるか
No
溶血性(材料由来)の評価
Yes
溶血性(材料由来、機械的)及び血液学、必要に応じ血液
凝固、血小板活性化、補体の評価
※既承認の血液透析器、血液濾過器又は血液透析濾過器で使用前例のある半透膜素材と同一の場
合で、且つ一般的名称が異なる場合には(例:中空糸型透析器と血液透析濾過器)、使用方法の違
いを考慮した評価を検討すること。
図1
表1
血液適合性の評価の流れ
推定されるリスク要因と評価すべき項目の基本的考え方
評価カテゴリ(試験又は試験以外)※
溶血性
推定されるリスク要因
材料
由来
1.溶出物特性が既存の医療機器
と異なる
2.血液接触表面の性状が既存の
医療機器と異なる
血栓形成(in vitro)
機械的
血液
凝固
血小板
活性化
補体
血液学
●
〇
〇
〇
●
●
※:●は「評価」、〇は「必要に応じて評価」を意味しており、試験によらずとも毒性リスクが許容でき
るか否かは、ISO 10993-1、ISO 10993-18等のデシジョンツリーを用いて既存データ(自社基準を含む)によ
り総合的に判断する。各評価項目について、他の試験結果等により評価できる場合には試験不要である。
なお、推定されるリスク要因の2.については、機械的溶血性及び血液学では評価が不十分な場合には、血液
凝固、血小板活性化及び補体のうち、必要なものを評価する。
6 / 30