よむ、つかう、まなぶ。
【資料1-3】承認基準改正案 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28311.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第6回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ドブラスト、酸処理、サンドブラスト+酸処理、粗面化のための陽極酸化処理、ワイヤカット放電
加工、窒化チタンによる着色処理、及び干渉色を発現させるための陽極酸化処理に限り、及びハイド
ロキシアパタイトによるコーティング処理とし、無処理も含む。
ただし、表面処理層と原材料である素地との間に、表面処理層及び素地とは異なる層又は物質を形
成する前処理を行うもの(いわゆるコーティング加工)を除く。
3.10 最終製品
その製品が使用される状態にある歯科材料をいう。ただし、滅菌品又は用時加工・調整される製
品については、滅菌後のもの又は加工・調整後のものをいう。
3.11 つる巻き線
円筒又は円すいの表面に沿って、軸方向移動と軸線の周りの回転角との比が、一定であるような
点が描く軌跡をいう。
4.要求事項材料及び形状・構造
4.13 原材料
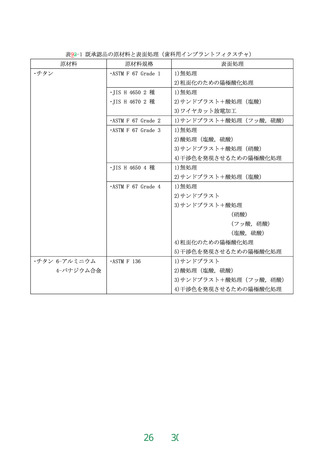
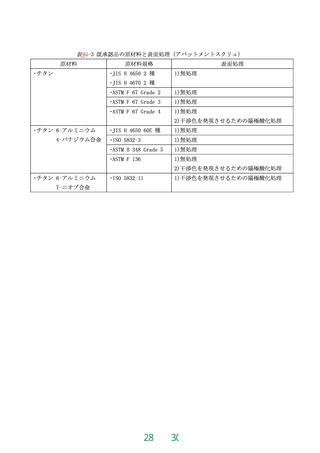
原材料は、歯科用インプラントフィクスチャにあっては、表2-1に掲げられた原材料でなければ
ならない。歯科用インプラントアバットメントにあっては、既承認品と同一でなければならない。
既承認品の原材料を表9-12-2~表9-32-3 に例示する。表に記載のない歯科用インプラントアバッ
トメントの既承認品の原材料は、該当する既承認品の医療機器承認番号、製造販売業者名、販売名
等を記載するとともに、既承認品の原材料と同一であることを示さなければならない。
4.21 外観
目視にて観察したとき、形状の異常、表面のバリ、傷、異物の付着・被覆等を認めてはならな
い。
4.32 形状、構造
a)形状
形状は次のとおりであり、確認できるカラー写真等を添付する。
歯科用インプラントフィクスチャ、歯科用骨内インプラント材についてはスクリュ形状を含む概
略円柱状であってる。、骨内埋入部最大直径及び全長が表1 の範囲内のものとする。
b)寸法
寸法及びその規格値を記した図面(嵌合部分を含む。) を示し、歯科用インプラントアバットメ
ントについては各用途を記載する。各主要寸法箇所は図1に示すとおりであり、その値は次によ
る。
歯科用インプラントアバットメントは概略円柱状の部分、及びスクリュ形状の部分から成るもの
とし、歯科用インプラントフィクスチャと歯科用インプラントアバットメントとの各主軸がなす角
度が30度以下のものとする。
表1 歯科用インプラントフィクスチャ、及び歯科用骨内インプラント材の主要寸法
主要寸法箇所
1 ピースタイプ
17 / 30
2 ピースタイプ
加工、窒化チタンによる着色処理、及び干渉色を発現させるための陽極酸化処理に限り、及びハイド
ロキシアパタイトによるコーティング処理とし、無処理も含む。
ただし、表面処理層と原材料である素地との間に、表面処理層及び素地とは異なる層又は物質を形
成する前処理を行うもの(いわゆるコーティング加工)を除く。
3.10 最終製品
その製品が使用される状態にある歯科材料をいう。ただし、滅菌品又は用時加工・調整される製
品については、滅菌後のもの又は加工・調整後のものをいう。
3.11 つる巻き線
円筒又は円すいの表面に沿って、軸方向移動と軸線の周りの回転角との比が、一定であるような
点が描く軌跡をいう。
4.要求事項材料及び形状・構造
4.13 原材料
原材料は、歯科用インプラントフィクスチャにあっては、表2-1に掲げられた原材料でなければ
ならない。歯科用インプラントアバットメントにあっては、既承認品と同一でなければならない。
既承認品の原材料を表9-12-2~表9-32-3 に例示する。表に記載のない歯科用インプラントアバッ
トメントの既承認品の原材料は、該当する既承認品の医療機器承認番号、製造販売業者名、販売名
等を記載するとともに、既承認品の原材料と同一であることを示さなければならない。
4.21 外観
目視にて観察したとき、形状の異常、表面のバリ、傷、異物の付着・被覆等を認めてはならな
い。
4.32 形状、構造
a)形状
形状は次のとおりであり、確認できるカラー写真等を添付する。
歯科用インプラントフィクスチャ、歯科用骨内インプラント材についてはスクリュ形状を含む概
略円柱状であってる。、骨内埋入部最大直径及び全長が表1 の範囲内のものとする。
b)寸法
寸法及びその規格値を記した図面(嵌合部分を含む。) を示し、歯科用インプラントアバットメ
ントについては各用途を記載する。各主要寸法箇所は図1に示すとおりであり、その値は次によ
る。
歯科用インプラントアバットメントは概略円柱状の部分、及びスクリュ形状の部分から成るもの
とし、歯科用インプラントフィクスチャと歯科用インプラントアバットメントとの各主軸がなす角
度が30度以下のものとする。
表1 歯科用インプラントフィクスチャ、及び歯科用骨内インプラント材の主要寸法
主要寸法箇所
1 ピースタイプ
17 / 30
2 ピースタイプ