よむ、つかう、まなぶ。
総-10-1○薬価算定の基準の改正について (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00175.html |
| 出典情報 | 中央社会保険医療協議会 総会(第538回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
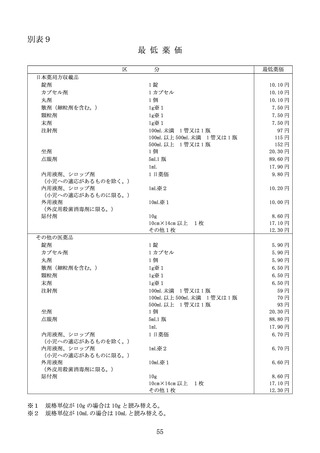
本規定の対象品目は、次のいずれかに該当する品目とする。
① 小児に係る効能又は効果等が追加された既収載品
医薬品医療機器等法第 14 条第9項(同法第 19 条の2第5項において準用
する場合を含む。以下同じ。)の規定に基づき小児に係る効能又は効果又
は用法及び用量が追加されたもの。ただし、当該効能又は効果等の追加の
承認の申請に当たって、当該申請に係る事項が医学薬学上公知であること
その他の合理的な理由により、臨床試験その他の試験の全部又は一部を新
たに実施することなく、文献等を添付することにより申請が可能であった
場合など、当該既収載品の製造販売業者の負担が相当程度低いと認められ
るものを除く。
② 希少疾病に係る効能又は効果等が追加された既収載品
医薬品医療機器等法第 14 条第9項の規定に基づき希少疾病に係る効能又
は効果又は用法及び用量が追加されたもの(希少疾病用医薬品又はそれに
相当すると認められるものに限る。)とする。ただし、当該効能又は効果
等の追加の承認の申請に当たって、当該申請に係る事項が医学薬学上公知
であることその他の合理的な理由により、臨床試験その他の試験の全部又
は一部を新たに実施することなく、文献等を添付することにより申請が可
能であった場合など、当該既収載品の製造販売業者の負担が相当程度低い
と認められるものを除く。
③ 先駆的な効能又は効果等が追加された既収載品
医薬品医療機器等法第 14 条第9項の規定に基づき効能又は効果又は用法
及び用量が追加された先駆的医薬品とする。ただし、当該効能又は効果等
の追加の承認の申請に当たって、当該申請に係る事項が医学薬学上公知で
あることその他の合理的な理由により、臨床試験その他の試験の全部又は
一部を新たに実施することなく、文献等を添付することにより申請が可能
であった場合など、当該既収載品の製造販売業者の負担が相当程度低いと
認められるものを除く。
④ 特定用途に係る効能又は効果等が追加された既収載品
医薬品医療機器等法第 14 条第9項の規定に基づき効能又は効果又は用法
及び用量が追加された特定用途医薬品とする。ただし、当該効能又は効果
等の追加の承認の申請に当たって、当該申請に係る事項が医学薬学上公知
であることその他の合理的な理由により、臨床試験その他の試験の全部又
は一部を新たに実施することなく、文献等を添付することにより申請が可
能であった場合など、当該既収載品の製造販売業者の負担が相当程度低い
と認められるものを除く。
28
① 小児に係る効能又は効果等が追加された既収載品
医薬品医療機器等法第 14 条第9項(同法第 19 条の2第5項において準用
する場合を含む。以下同じ。)の規定に基づき小児に係る効能又は効果又
は用法及び用量が追加されたもの。ただし、当該効能又は効果等の追加の
承認の申請に当たって、当該申請に係る事項が医学薬学上公知であること
その他の合理的な理由により、臨床試験その他の試験の全部又は一部を新
たに実施することなく、文献等を添付することにより申請が可能であった
場合など、当該既収載品の製造販売業者の負担が相当程度低いと認められ
るものを除く。
② 希少疾病に係る効能又は効果等が追加された既収載品
医薬品医療機器等法第 14 条第9項の規定に基づき希少疾病に係る効能又
は効果又は用法及び用量が追加されたもの(希少疾病用医薬品又はそれに
相当すると認められるものに限る。)とする。ただし、当該効能又は効果
等の追加の承認の申請に当たって、当該申請に係る事項が医学薬学上公知
であることその他の合理的な理由により、臨床試験その他の試験の全部又
は一部を新たに実施することなく、文献等を添付することにより申請が可
能であった場合など、当該既収載品の製造販売業者の負担が相当程度低い
と認められるものを除く。
③ 先駆的な効能又は効果等が追加された既収載品
医薬品医療機器等法第 14 条第9項の規定に基づき効能又は効果又は用法
及び用量が追加された先駆的医薬品とする。ただし、当該効能又は効果等
の追加の承認の申請に当たって、当該申請に係る事項が医学薬学上公知で
あることその他の合理的な理由により、臨床試験その他の試験の全部又は
一部を新たに実施することなく、文献等を添付することにより申請が可能
であった場合など、当該既収載品の製造販売業者の負担が相当程度低いと
認められるものを除く。
④ 特定用途に係る効能又は効果等が追加された既収載品
医薬品医療機器等法第 14 条第9項の規定に基づき効能又は効果又は用法
及び用量が追加された特定用途医薬品とする。ただし、当該効能又は効果
等の追加の承認の申請に当たって、当該申請に係る事項が医学薬学上公知
であることその他の合理的な理由により、臨床試験その他の試験の全部又
は一部を新たに実施することなく、文献等を添付することにより申請が可
能であった場合など、当該既収載品の製造販売業者の負担が相当程度低い
と認められるものを除く。
28