よむ、つかう、まなぶ。
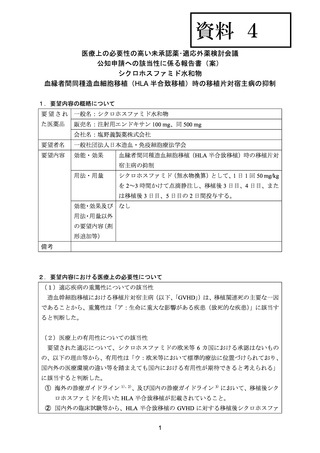
資料4 シクロホスファミド水和物 (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00027.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第55回 5/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
34) Tanaka T, et al. A phase I/II multicenter trial of HLA-Haploidentical PBSCT with PTCy for
aggressive adult T cell leukemia/lymphoma. Transplant Cell Ther 2021: 27: 928 e1-7. 49)
27~64 歳の成人 T 細胞白血病リンパ腫患者 18 例を対象に、移植後シクロホスファミド
を用いた HLA 半合致移植の安全性及び有効性を検討する臨床試験(UMIN000021783)が実
施された。移植前処置として強度減弱前処置が施行され、GVHD の予防を目的として、TAC、
シクロホスファミド(50 mg/kg を移植後 3 日目及び 5 日目に投与)及び MMF が用いられ
た。
主要評価項目とされた、移植 60 日後までにグレード III/IV の急性 GVHD が認められず、
生着が認められ、生存している被験者の割合は 89%であった。
移植 100 日後までのグレード II~IV の急性 GVHD 発現割合は 39%、グレード III/IV の急
性 GVHD 発現割合は 11%であり、移植 1 年後までの中等度から重度の慢性 GVHD 発現割
合は 17%であった。
安全性について、血液系以外でグレード 3 以上の有害事象が 14 例(78%)に認められ、
このうちグレード 4 の有害事象は 3 例に認められた。グレード 2 以上の心毒性は 4 例に認
められ、グレード 3 の心嚢液貯留(移植後 11 日目)
、グレード 2 の発作性心房細動(移植
後 9 日目)が「移植後シクロホスファミドと関連あるかもしれない」とされた。出血性膀
胱炎は 6 例(33%)に認められた。移植後 1 年以内に 2/18 例が死亡し、死因は非感染性肺
損傷(移植後 230 日目)及び敗血症性ショック(移植後 293 日目)が各 1 例であった。
小児
35) Osumi T, et. al. Prospective study of allogeneic hematopoietic stem cell transplantation with
post-transplantation cyclophosphamide and antithymocyte globulin from HLA-mismatched
related donors for nonmalignant diseases. Biol. Blood Marrow Transplant 2020; 26: e286-91.
50)
7 カ月~15 歳の非腫瘍性疾患患者 6 例を対象に、移植後シクロホスファミドと ATG を併
用した HLA 半合致移植の安全性及び有効性を検討する臨床試験(jRCTs031180397)が実施
された。GVHD の予防を目的として、ATG(総投与量 2.5 mg/kg を移植前 8 日目から 5 日目
まで分割投与)
、シクロホスファミド(50 mg/kg を移植後 3 日目及び 4 日目に投与)
、MMF
及び TAC が用いられた。
主要評価項目は、移植 30 日後までのイベント(グレード III 以上の急性 GVHD、生着不
全又は死亡)発生割合とされた。6 例全例で生着が認められ(中央値 14.5 日〈範囲 12~24
日〉)、
グレード II 以上の急性 GVHD 及び死亡は認められなかった(グレード I の急性 GVHD
は 4 例に発現)
。また、最終観察時点(中央値 565 日〈範囲 282~1,108 日〉
)まで慢性 GVHD
は認められなかった。
安全性について、CMV の再活性化が 1 例、グレード 3 の発熱性好中球減少症が 3 例、血
球貪食性リンパ組織球症が 1 例に認められた。グレード 2 の膀胱炎が 2 例に認められ、シ
22
aggressive adult T cell leukemia/lymphoma. Transplant Cell Ther 2021: 27: 928 e1-7. 49)
27~64 歳の成人 T 細胞白血病リンパ腫患者 18 例を対象に、移植後シクロホスファミド
を用いた HLA 半合致移植の安全性及び有効性を検討する臨床試験(UMIN000021783)が実
施された。移植前処置として強度減弱前処置が施行され、GVHD の予防を目的として、TAC、
シクロホスファミド(50 mg/kg を移植後 3 日目及び 5 日目に投与)及び MMF が用いられ
た。
主要評価項目とされた、移植 60 日後までにグレード III/IV の急性 GVHD が認められず、
生着が認められ、生存している被験者の割合は 89%であった。
移植 100 日後までのグレード II~IV の急性 GVHD 発現割合は 39%、グレード III/IV の急
性 GVHD 発現割合は 11%であり、移植 1 年後までの中等度から重度の慢性 GVHD 発現割
合は 17%であった。
安全性について、血液系以外でグレード 3 以上の有害事象が 14 例(78%)に認められ、
このうちグレード 4 の有害事象は 3 例に認められた。グレード 2 以上の心毒性は 4 例に認
められ、グレード 3 の心嚢液貯留(移植後 11 日目)
、グレード 2 の発作性心房細動(移植
後 9 日目)が「移植後シクロホスファミドと関連あるかもしれない」とされた。出血性膀
胱炎は 6 例(33%)に認められた。移植後 1 年以内に 2/18 例が死亡し、死因は非感染性肺
損傷(移植後 230 日目)及び敗血症性ショック(移植後 293 日目)が各 1 例であった。
小児
35) Osumi T, et. al. Prospective study of allogeneic hematopoietic stem cell transplantation with
post-transplantation cyclophosphamide and antithymocyte globulin from HLA-mismatched
related donors for nonmalignant diseases. Biol. Blood Marrow Transplant 2020; 26: e286-91.
50)
7 カ月~15 歳の非腫瘍性疾患患者 6 例を対象に、移植後シクロホスファミドと ATG を併
用した HLA 半合致移植の安全性及び有効性を検討する臨床試験(jRCTs031180397)が実施
された。GVHD の予防を目的として、ATG(総投与量 2.5 mg/kg を移植前 8 日目から 5 日目
まで分割投与)
、シクロホスファミド(50 mg/kg を移植後 3 日目及び 4 日目に投与)
、MMF
及び TAC が用いられた。
主要評価項目は、移植 30 日後までのイベント(グレード III 以上の急性 GVHD、生着不
全又は死亡)発生割合とされた。6 例全例で生着が認められ(中央値 14.5 日〈範囲 12~24
日〉)、
グレード II 以上の急性 GVHD 及び死亡は認められなかった(グレード I の急性 GVHD
は 4 例に発現)
。また、最終観察時点(中央値 565 日〈範囲 282~1,108 日〉
)まで慢性 GVHD
は認められなかった。
安全性について、CMV の再活性化が 1 例、グレード 3 の発熱性好中球減少症が 3 例、血
球貪食性リンパ組織球症が 1 例に認められた。グレード 2 の膀胱炎が 2 例に認められ、シ
22