よむ、つかう、まなぶ。
別紙2 (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00042.html |
| 出典情報 | 先進医療会議(第108回先進医療会議、第129回先進医療技術審査部会 3/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
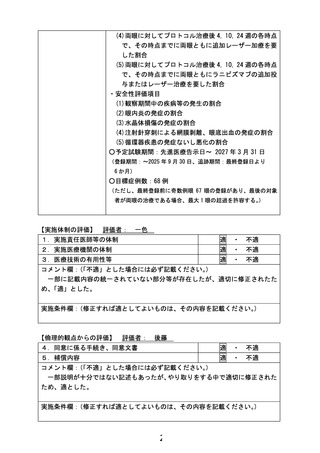
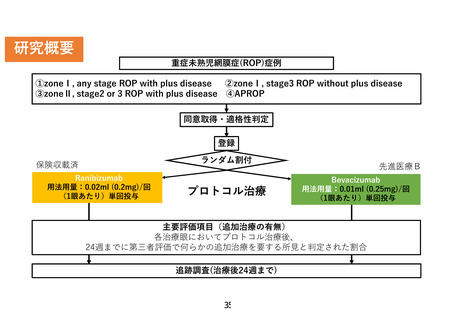
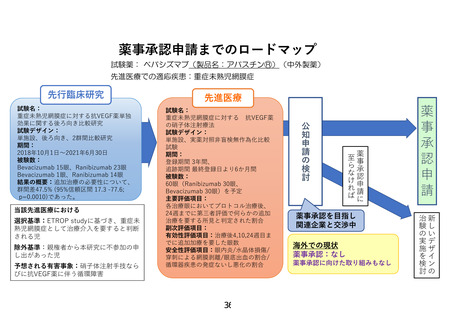
3)について、ご指摘のとおり、抗 VEGF 薬の安全性は、小児の全身への影響という意味では、明確な
副作用の知見は集積されておりません。これは現在までに未熟児網膜症に対する抗 VEGF 薬の治療報
告において、そのような副作用の報告が非常に少ないからです。未熟児網膜症に使用する抗 VEGF 薬
は成人眼への投与量と比較し、ルセンティスで 2/5、アバスチンが 1/5 であり、薬剤の投与量そのものが
非常に少なく、全身への影響が小さくなることがその理由と考えられます。しかしながら現段階で、アバ
スチンの全身への副作用が全くないとは言えませんので、合併症に関しましては未熟児網膜症に対す
るアバスチンを含めた抗 VEGF 薬の治療論文に報告されている項目、およびアバスチンの抗がん剤に
かかる添付文書上の副作用として記載された項目を用いて評価するのがよいと考えます。これらについ
ては、事前照会事項に対する回答5の指摘に従い、アバスチンとルセンティス各々の合併症に書き分け
たうえで、研究計画書 3.2 項に修正記載いたしました。
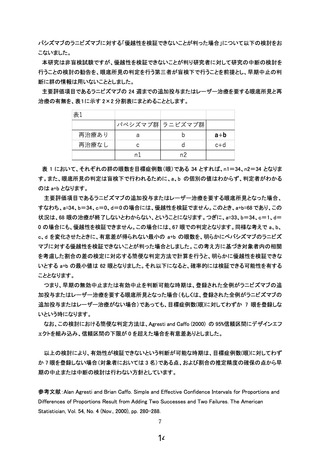
4.同意説明文書に、硝子体注射がどのような注射なのか、どこにも書いていないので、付け加えて
頂きたい。
【回答】
ご指摘を頂きましてありがとうございます。硝子体注射に関しまして、同意説明文書 4 項に説明を追加
記載いたしました。
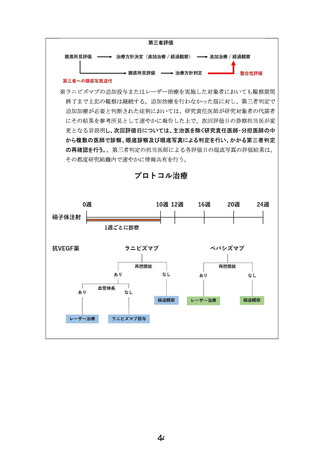
5.同意説明文書に、今回、両方の薬剤を比べるだけではなく、そのあと「必要に応じてレーザー加療
または手術による追加治療を行うことになります。ルセンティス®の追加投与またはレーザー治療を
行った赤ちゃんにおいても、研究計画に定められた観察期間の終わりまで担当医師が赤ちゃんの状
態の観察を続けます。」(6 頁)とあるが、今回の研究のエンドポイントが理解できない説明である。追
加治療は研究ではなく、治療として行うという意味なのか。そうだとすれば、研究の対象ではなくなる
と考えるが、そのあたりを明確にして頂きたい。
【回答】
ご指摘を頂きましてありがとうございます。ルセンティス®の追加投与やレーザー治療は、ご指摘の通
り「治療」として実施いたします。しかしながら、初回の抗 VEGF 薬硝子体注射に対する、研究計画書
6.2.2 項に記載の安全性評価項目については注射後 24 週までフォローアップするため、ルセンティス®の
追加投与またはレーザー治療を行った赤ちゃんにおいても、研究計画に定められた観察期間の終わり
まで観察は続けることとしております。
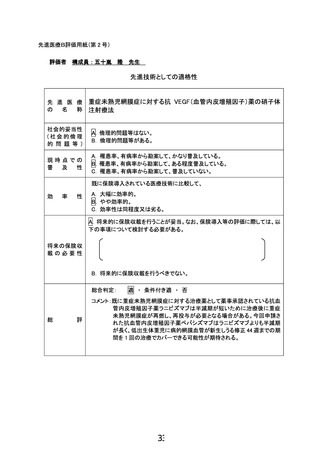
6.同意説明文書にアバスチンを未熟児網膜症の治療に使った場合の、危険性について、説明して頂
きたい。抗がん剤としての使用についての説明では説明になっていないと考える。
3
22
副作用の知見は集積されておりません。これは現在までに未熟児網膜症に対する抗 VEGF 薬の治療報
告において、そのような副作用の報告が非常に少ないからです。未熟児網膜症に使用する抗 VEGF 薬
は成人眼への投与量と比較し、ルセンティスで 2/5、アバスチンが 1/5 であり、薬剤の投与量そのものが
非常に少なく、全身への影響が小さくなることがその理由と考えられます。しかしながら現段階で、アバ
スチンの全身への副作用が全くないとは言えませんので、合併症に関しましては未熟児網膜症に対す
るアバスチンを含めた抗 VEGF 薬の治療論文に報告されている項目、およびアバスチンの抗がん剤に
かかる添付文書上の副作用として記載された項目を用いて評価するのがよいと考えます。これらについ
ては、事前照会事項に対する回答5の指摘に従い、アバスチンとルセンティス各々の合併症に書き分け
たうえで、研究計画書 3.2 項に修正記載いたしました。
4.同意説明文書に、硝子体注射がどのような注射なのか、どこにも書いていないので、付け加えて
頂きたい。
【回答】
ご指摘を頂きましてありがとうございます。硝子体注射に関しまして、同意説明文書 4 項に説明を追加
記載いたしました。
5.同意説明文書に、今回、両方の薬剤を比べるだけではなく、そのあと「必要に応じてレーザー加療
または手術による追加治療を行うことになります。ルセンティス®の追加投与またはレーザー治療を
行った赤ちゃんにおいても、研究計画に定められた観察期間の終わりまで担当医師が赤ちゃんの状
態の観察を続けます。」(6 頁)とあるが、今回の研究のエンドポイントが理解できない説明である。追
加治療は研究ではなく、治療として行うという意味なのか。そうだとすれば、研究の対象ではなくなる
と考えるが、そのあたりを明確にして頂きたい。
【回答】
ご指摘を頂きましてありがとうございます。ルセンティス®の追加投与やレーザー治療は、ご指摘の通
り「治療」として実施いたします。しかしながら、初回の抗 VEGF 薬硝子体注射に対する、研究計画書
6.2.2 項に記載の安全性評価項目については注射後 24 週までフォローアップするため、ルセンティス®の
追加投与またはレーザー治療を行った赤ちゃんにおいても、研究計画に定められた観察期間の終わり
まで観察は続けることとしております。
6.同意説明文書にアバスチンを未熟児網膜症の治療に使った場合の、危険性について、説明して頂
きたい。抗がん剤としての使用についての説明では説明になっていないと考える。
3
22