よむ、つかう、まなぶ。
別紙2 (43 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00042.html |
| 出典情報 | 先進医療会議(第108回先進医療会議、第129回先進医療技術審査部会 3/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【別添6】
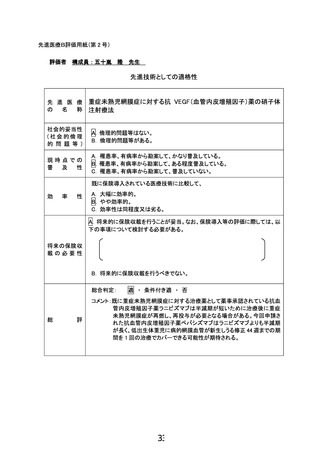
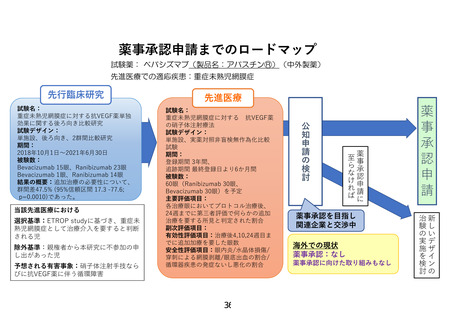
「重症未熟児網膜症に対する抗 VEGF(血管内皮増殖因子)薬の硝子体
注射療法」の治療計画(申請書類より抜粋)
6.治療計画
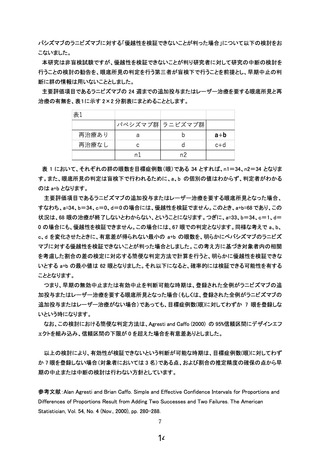
患者登録方法
本研究は新生児を対象とし、患者本人から同意を得ることができないため、担当医は、
研究対象者候補の代諾者(患児の親権者)に本研究計画書に付随する説明文書を用いて説
明を行い、質問する機会、及び同意するかどうかを判断するための十分な時間を与え、本
研究の内容を良く理解したことを確認した上で、自由意思による文書同意を得る。親権者
全員からの同意が得られない場合は登録不可とする。
検査・治療
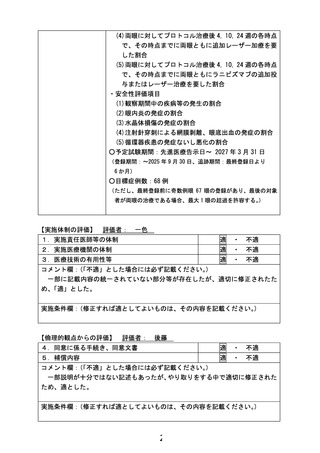
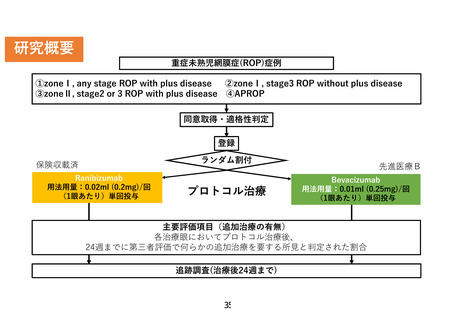
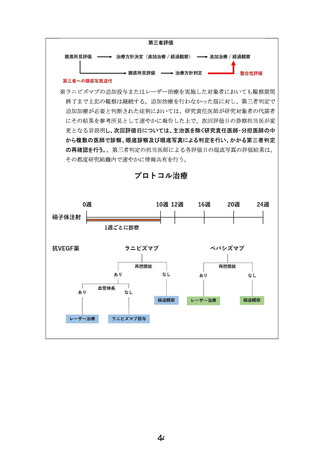
①治療開始前にフルオレサイトによる蛍光眼底造影検査を行う。
②1 眼につき 1 回、ベバシズマブ 0.01ml (0.25mg) もしくはラニビズマブ 0.02ml
(0.2mg) を硝子体注射として投与する。
③初回治療後 10 週までは週 1 回の眼底検査を行い、再燃兆候があれば以下いずれかの
基準に準じて追加治療を行う。再燃徴候を認める場合、すべて再治療の対象となる。
再燃兆候の定義:血管拡張蛇行の悪化、もしくは ETROP study の診断基準に基づく stage
の上昇とする。
・Ranibizumab 群で初回治療後 4 週間以上経過し、かつ再燃徴候があり著明な線維血管
膜の増加がなく、かつ血管伸長が不良である症例:Ranibizumab の再投与を行う。
・Bevacizumab 群または上記以外の Ranibizumab 群で再治療を要する症例:レーザー治
療を行う。
・再燃徴候を認めない症例:経過観察を継続する。
④以降は 24 週目まで定期的な診察を継続し、再燃兆候が認められればレーザーによる
追加加療を行う。
(以下 2 つの※については③④へ適用する)
※追加加療を行う場合は、研究責任医師が診断ののち追加加療を行うが、客観性を担保
するため、追加治療前に眼底写真を撮影し、研究分担医師ではなく、未熟児網膜症の
診療について第三者の立場の医師が、患者情報をマスクされた画像を確認し、治療の
要否について独立した判定を行う。この評価は、あくまで治療においては、研究に伴
う参考所見とする。
※第三者判定は未熟児網膜症の診療においてベバシズマブあるいはラニビズマブの硝
子体注射やレーザー加療の技術を有し、かつ本研究の責任者・分担者ではない眼科医
師により行われる。当該判定者は盲検性を維持するため、対象者のカルテにはアクセ
スしない。第三者判定は各評価日において撮影した眼底写真をもとに行われる。撮影
した眼底写真は当日中に第三者判定の担当医師へ送付される。第三者判定の担当医師
は判定結果を 3 日以内に EDC へ直接入力し、速やかに研究責任医師へ報告する。
43
「重症未熟児網膜症に対する抗 VEGF(血管内皮増殖因子)薬の硝子体
注射療法」の治療計画(申請書類より抜粋)
6.治療計画
患者登録方法
本研究は新生児を対象とし、患者本人から同意を得ることができないため、担当医は、
研究対象者候補の代諾者(患児の親権者)に本研究計画書に付随する説明文書を用いて説
明を行い、質問する機会、及び同意するかどうかを判断するための十分な時間を与え、本
研究の内容を良く理解したことを確認した上で、自由意思による文書同意を得る。親権者
全員からの同意が得られない場合は登録不可とする。
検査・治療
①治療開始前にフルオレサイトによる蛍光眼底造影検査を行う。
②1 眼につき 1 回、ベバシズマブ 0.01ml (0.25mg) もしくはラニビズマブ 0.02ml
(0.2mg) を硝子体注射として投与する。
③初回治療後 10 週までは週 1 回の眼底検査を行い、再燃兆候があれば以下いずれかの
基準に準じて追加治療を行う。再燃徴候を認める場合、すべて再治療の対象となる。
再燃兆候の定義:血管拡張蛇行の悪化、もしくは ETROP study の診断基準に基づく stage
の上昇とする。
・Ranibizumab 群で初回治療後 4 週間以上経過し、かつ再燃徴候があり著明な線維血管
膜の増加がなく、かつ血管伸長が不良である症例:Ranibizumab の再投与を行う。
・Bevacizumab 群または上記以外の Ranibizumab 群で再治療を要する症例:レーザー治
療を行う。
・再燃徴候を認めない症例:経過観察を継続する。
④以降は 24 週目まで定期的な診察を継続し、再燃兆候が認められればレーザーによる
追加加療を行う。
(以下 2 つの※については③④へ適用する)
※追加加療を行う場合は、研究責任医師が診断ののち追加加療を行うが、客観性を担保
するため、追加治療前に眼底写真を撮影し、研究分担医師ではなく、未熟児網膜症の
診療について第三者の立場の医師が、患者情報をマスクされた画像を確認し、治療の
要否について独立した判定を行う。この評価は、あくまで治療においては、研究に伴
う参考所見とする。
※第三者判定は未熟児網膜症の診療においてベバシズマブあるいはラニビズマブの硝
子体注射やレーザー加療の技術を有し、かつ本研究の責任者・分担者ではない眼科医
師により行われる。当該判定者は盲検性を維持するため、対象者のカルテにはアクセ
スしない。第三者判定は各評価日において撮影した眼底写真をもとに行われる。撮影
した眼底写真は当日中に第三者判定の担当医師へ送付される。第三者判定の担当医師
は判定結果を 3 日以内に EDC へ直接入力し、速やかに研究責任医師へ報告する。
43