よむ、つかう、まなぶ。
資料2-10-2 シルガード9懸濁筋注シリンジ全例登録による強化安全監視活動最終報告書[1.9MB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00106.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第102回 7/29)医薬品等安全対策部会安全対策調査会(令和6年度第4回 7/29)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
目次
頁
1
全例登録による強化安全監視活動の実施経緯及びその目的 ......................................................... 5
2
全例登録による強化安全監視活動の実施方法 ................................................................................. 6
3
2.1
医療機関への納入前に実施する活動内容の事前説明、及び協力依頼 ................................. 6
2.2
被接種者の登録 ............................................................................................................................. 7
2.2.1
システムを利用した登録 ..................................................................................................... 7
2.2.2
紙の登録票を利用した登録 ................................................................................................. 7
2.3
有害事象の収集 ............................................................................................................................. 7
2.4
被接種者と有害事象情報の紐付け ............................................................................................. 8
2.5
「多様な症状」発現時の転帰フォローアップの協力依頼 ..................................................... 8
2.5.1
「多様な症状」発現症例に対する転帰フォローアップの依頼 ..................................... 8
2.5.2
転帰フォローアップの追加の協力依頼 ........................................................................... 8
実施報告 ................................................................................................................................................. 8
3.1
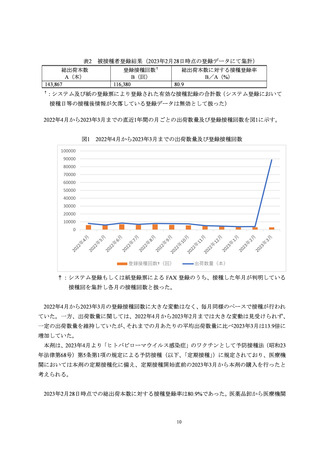
被接種者の登録結果 ..................................................................................................................... 9
3.2
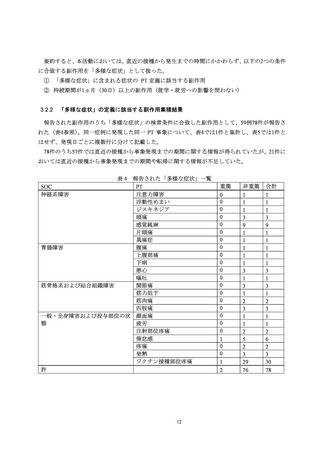
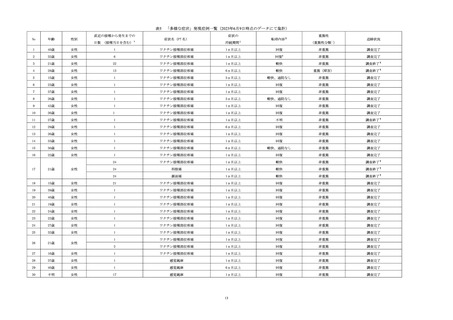
「多様な症状」の集積結果 ....................................................................................................... 11
3.2.1
「多様な症状」の定義 ....................................................................................................... 11
3.2.2
「多様な症状」の定義に該当する副作用集積結果 ....................................................... 12
3.3
「多様な症状」発現症例 ........................................................................................................... 16
3.4
「多様な症状」の発現割合 ....................................................................................................... 17
4
注射部位反応に関する副作用 ........................................................................................................... 18
5
包括的安全性情報 ............................................................................................................................... 20
5.1
副作用 ........................................................................................................................................... 20
5.1.1
副作用発現状況 ................................................................................................................... 20
5.1.2
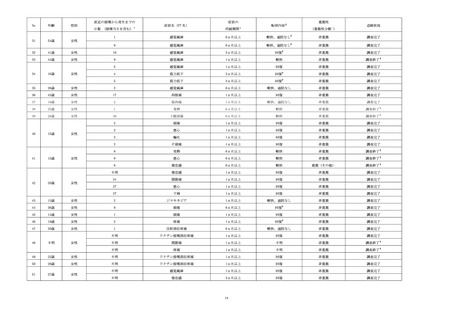
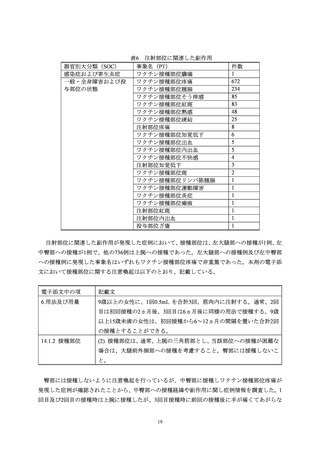
器官別大分類(SOC)別副作用発現状況 ....................................................................... 21
5.1.3
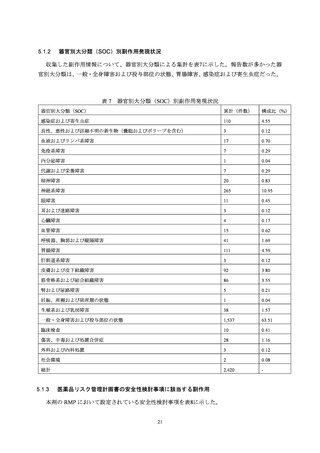
医薬品リスク管理計画書の安全性検討事項に該当する副作用 ................................... 21
5.1.3.1
重要な特定されたリスク ........................................................................................... 22
5.1.3.1.1
過敏症反応(アナフィラキシー、気管支痙攣、蕁麻疹等)........................ 22
5.1.3.1.2
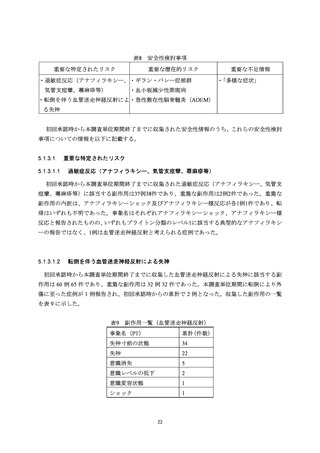
転倒を伴う血管迷走神経反射による失神 ....................................................... 22
5.1.3.2
重要な潜在的リスク ................................................................................................... 23
5.1.3.2.1
ギラン・バレー症候群 ....................................................................................... 23
5.1.3.2.2
血小板減少性紫斑病 ........................................................................................... 23
5.1.3.2.3
急性散在性脳脊髄炎(ADEM) ....................................................................... 23
5.1.3.3
重要な不足情報 ........................................................................................................... 23
5.1.4
重篤な副作用 ....................................................................................................................... 25
5.1.5
未知の副作用 ....................................................................................................................... 25
2
頁
1
全例登録による強化安全監視活動の実施経緯及びその目的 ......................................................... 5
2
全例登録による強化安全監視活動の実施方法 ................................................................................. 6
3
2.1
医療機関への納入前に実施する活動内容の事前説明、及び協力依頼 ................................. 6
2.2
被接種者の登録 ............................................................................................................................. 7
2.2.1
システムを利用した登録 ..................................................................................................... 7
2.2.2
紙の登録票を利用した登録 ................................................................................................. 7
2.3
有害事象の収集 ............................................................................................................................. 7
2.4
被接種者と有害事象情報の紐付け ............................................................................................. 8
2.5
「多様な症状」発現時の転帰フォローアップの協力依頼 ..................................................... 8
2.5.1
「多様な症状」発現症例に対する転帰フォローアップの依頼 ..................................... 8
2.5.2
転帰フォローアップの追加の協力依頼 ........................................................................... 8
実施報告 ................................................................................................................................................. 8
3.1
被接種者の登録結果 ..................................................................................................................... 9
3.2
「多様な症状」の集積結果 ....................................................................................................... 11
3.2.1
「多様な症状」の定義 ....................................................................................................... 11
3.2.2
「多様な症状」の定義に該当する副作用集積結果 ....................................................... 12
3.3
「多様な症状」発現症例 ........................................................................................................... 16
3.4
「多様な症状」の発現割合 ....................................................................................................... 17
4
注射部位反応に関する副作用 ........................................................................................................... 18
5
包括的安全性情報 ............................................................................................................................... 20
5.1
副作用 ........................................................................................................................................... 20
5.1.1
副作用発現状況 ................................................................................................................... 20
5.1.2
器官別大分類(SOC)別副作用発現状況 ....................................................................... 21
5.1.3
医薬品リスク管理計画書の安全性検討事項に該当する副作用 ................................... 21
5.1.3.1
重要な特定されたリスク ........................................................................................... 22
5.1.3.1.1
過敏症反応(アナフィラキシー、気管支痙攣、蕁麻疹等)........................ 22
5.1.3.1.2
転倒を伴う血管迷走神経反射による失神 ....................................................... 22
5.1.3.2
重要な潜在的リスク ................................................................................................... 23
5.1.3.2.1
ギラン・バレー症候群 ....................................................................................... 23
5.1.3.2.2
血小板減少性紫斑病 ........................................................................................... 23
5.1.3.2.3
急性散在性脳脊髄炎(ADEM) ....................................................................... 23
5.1.3.3
重要な不足情報 ........................................................................................................... 23
5.1.4
重篤な副作用 ....................................................................................................................... 25
5.1.5
未知の副作用 ....................................................................................................................... 25
2