よむ、つかう、まなぶ。
資料2-10-2 シルガード9懸濁筋注シリンジ全例登録による強化安全監視活動最終報告書[1.9MB] (32 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00106.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第102回 7/29)医薬品等安全対策部会安全対策調査会(令和6年度第4回 7/29)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
シルガード®9 水性懸濁筋注シリンジ
全例登録による強化安全監視活動
企業見解書
「全例登録
による強化
安全監視活
動」を行う
ことになっ
た経緯
「全例登録
による強化
安全監視活
動」の目的
「全例登録
による強化
安全監視活
動」の結果
及び考察
2 価/4 価の HPV ワクチンの接種後に、広い範囲に広がる痛み、手足の動かしにくさ、不
随意運動などを中心とする「多様な症状」を発現した症例が報告されたことから、2 価/4 価
の HPV ワクチンは 2013 年 6 月より定期接種ワクチンであるものの積極的な接種勧奨が差
し控えられた。その後、厚生労働省により様々な調査が行われ、副反応検討部会において
その結果を議論されたが、積極的な勧奨の差し控えは 2021 年 11 月 26 日に差し控えを終
了する旨の厚生労働省健康局長通知が発出されるまで、継続されることとなった。
HPV ワクチンの積極的な勧奨が差し控えられている状況下、組換え沈降 9 価ヒトパピロー
マウイルス様粒子ワクチン(酵母由来)(販売名:シルガード®9 水性懸濁筋注シリンジ、
以下、本剤)は 2020 年 7 月 21 日に承認された。2 価/4 価の HPV ワクチンにおいては様々
な症状を発現した症例が複数の医療機関を受診した結果、医療機関から報告された副作用
情報を特定の被接種者に紐づけて適切に把握、追跡することが困難な状況があったことか
ら、本剤の審査時の検討において(https://www.mhlw.go.jp/stf/newpage_12438.html)
、副作用
情報を入手した際に、その症例を特定し紐付けできるようにするため、承認後の一定期間
は接種された全例を把握することが可能となる方策を検討すべきであると判断され、本剤
の承認条件である医薬品リスク管理計画書にて、全例登録による強化安全監視活動(以下、
本活動)の実施が規定された。
詳細は全例登録による強化安全監視活動最終報告書の 1 項参照。
すべての被接種者を登録し既往歴を含む背景情報を入力可能なシステムを構築するこ
とにより、少なくとも販売開始後 2 年間における本剤の被接種者全例を把握する。この
全例登録システムにより、本剤接種と時間的に関連して「多様な症状」を発現し副反応
疑いとして報告された症例を特定し、その症例を追跡することで本剤の被接種者集団
全体における「多様な症状」の発現状況を把握する。
全被接種者を登録することで、
「多様な症状」に関連すると考えられる有害事象を発現
した症例についてシステム登録情報と紐付け、可能な限り回復又は治療不要となるま
で追跡して情報収集できる体制を整える。
詳細は全例登録による強化安全監視活動最終報告書の 1 項参照。
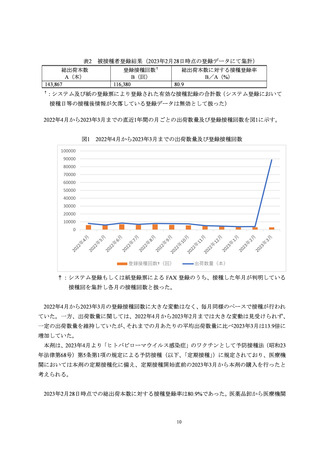
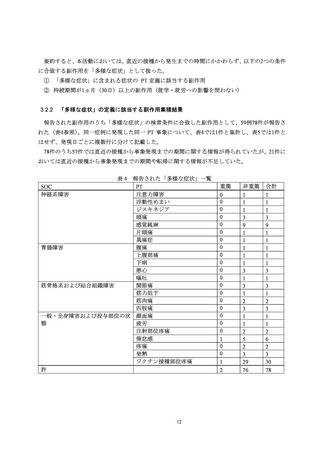
本活動を販売開始(2021 年 2 月 24 日)から実施し、登録期間を 2023 年 3 月 31 日に
終了した。登録された被接種者数は 47,971 人、登録接種回数は 119,761 回であった。
本剤の総出荷本数から算出される推定接種率から概ね全接種が登録集積されている
と考えられた。
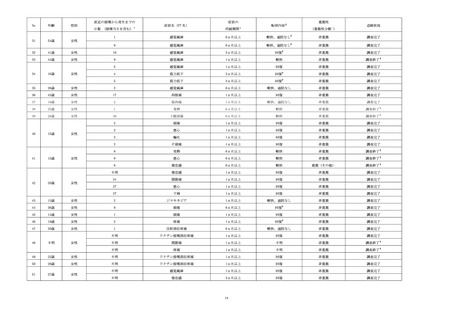
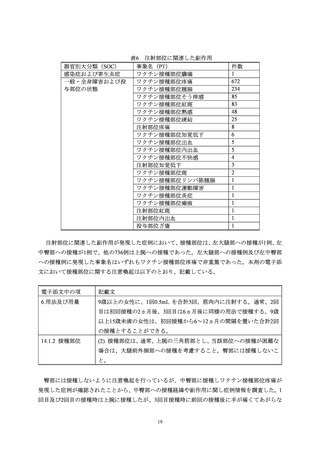
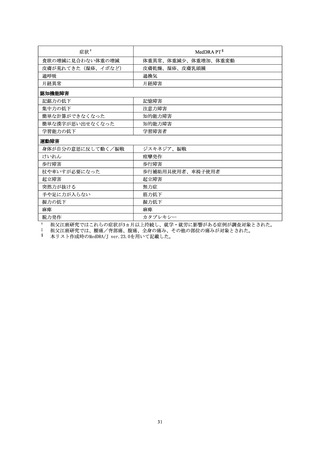
本活動で登録された被接種者に発現した副作用のうち、
「多様な症状」の定義に該当し
た副作用は 59 例 78 件であった。3 件以上報告された PT は、ワクチン接種部位疼痛
(30 件)
、感覚鈍麻(9 件)、倦怠感(6 件)
、頭痛、悪心、関節痛、四肢痛、発熱(各
3 件)だった。重篤は 2 件(PT: 倦怠感、ワクチン接種部位疼痛)で、76 件は非重篤だ
った。
「多様な症状」を発現した 59 例 78 件に関し検討した結果、新たな安全性の懸念
は認められなかった。
「多様な症状」発現症例のうち、やむを得ず調査終了とした事例が 9 例あるものの、
本活動の登録期間を通じて全体的に有害事象情報の報告が徹底され、フォローアップ
依頼に対して医師の協力も得られた。これは納入にあたり、あらかじめ接種医等に対
して「多様な症状」に関する注意喚起及び被接種者に「多様な症状」が発現した際のフ
ォローアップの徹底を依頼したのみならず、実際に接種医等による副作用発生時のフ
ォローアップの重要性への理解及び協力が得られたことで達成できたと考えられた。
また、接種医等による被接種者への事前説明等により、本剤接種前の段階から、
「多様
な症状」発現時に備えた各医療機関における被接種者との連絡体制も強化されたと考
えている。
詳細は全例登録による強化安全監視活動最終報告書の 3 項及び 6 項参照。
本活動により適切に接種の登録を行い、
「多様な症状」を発現した症例の把握を行った結
果、本活動で登録された被接種者に発現した副作用のうち、
「多様な症状」の定義に該当し
た副作用において本剤接種との関連性を示す根拠の集積はなく、新たな安全性の懸念は認
32
全例登録による強化安全監視活動
企業見解書
「全例登録
による強化
安全監視活
動」を行う
ことになっ
た経緯
「全例登録
による強化
安全監視活
動」の目的
「全例登録
による強化
安全監視活
動」の結果
及び考察
2 価/4 価の HPV ワクチンの接種後に、広い範囲に広がる痛み、手足の動かしにくさ、不
随意運動などを中心とする「多様な症状」を発現した症例が報告されたことから、2 価/4 価
の HPV ワクチンは 2013 年 6 月より定期接種ワクチンであるものの積極的な接種勧奨が差
し控えられた。その後、厚生労働省により様々な調査が行われ、副反応検討部会において
その結果を議論されたが、積極的な勧奨の差し控えは 2021 年 11 月 26 日に差し控えを終
了する旨の厚生労働省健康局長通知が発出されるまで、継続されることとなった。
HPV ワクチンの積極的な勧奨が差し控えられている状況下、組換え沈降 9 価ヒトパピロー
マウイルス様粒子ワクチン(酵母由来)(販売名:シルガード®9 水性懸濁筋注シリンジ、
以下、本剤)は 2020 年 7 月 21 日に承認された。2 価/4 価の HPV ワクチンにおいては様々
な症状を発現した症例が複数の医療機関を受診した結果、医療機関から報告された副作用
情報を特定の被接種者に紐づけて適切に把握、追跡することが困難な状況があったことか
ら、本剤の審査時の検討において(https://www.mhlw.go.jp/stf/newpage_12438.html)
、副作用
情報を入手した際に、その症例を特定し紐付けできるようにするため、承認後の一定期間
は接種された全例を把握することが可能となる方策を検討すべきであると判断され、本剤
の承認条件である医薬品リスク管理計画書にて、全例登録による強化安全監視活動(以下、
本活動)の実施が規定された。
詳細は全例登録による強化安全監視活動最終報告書の 1 項参照。
すべての被接種者を登録し既往歴を含む背景情報を入力可能なシステムを構築するこ
とにより、少なくとも販売開始後 2 年間における本剤の被接種者全例を把握する。この
全例登録システムにより、本剤接種と時間的に関連して「多様な症状」を発現し副反応
疑いとして報告された症例を特定し、その症例を追跡することで本剤の被接種者集団
全体における「多様な症状」の発現状況を把握する。
全被接種者を登録することで、
「多様な症状」に関連すると考えられる有害事象を発現
した症例についてシステム登録情報と紐付け、可能な限り回復又は治療不要となるま
で追跡して情報収集できる体制を整える。
詳細は全例登録による強化安全監視活動最終報告書の 1 項参照。
本活動を販売開始(2021 年 2 月 24 日)から実施し、登録期間を 2023 年 3 月 31 日に
終了した。登録された被接種者数は 47,971 人、登録接種回数は 119,761 回であった。
本剤の総出荷本数から算出される推定接種率から概ね全接種が登録集積されている
と考えられた。
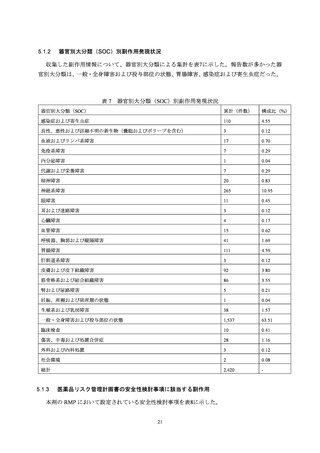
本活動で登録された被接種者に発現した副作用のうち、
「多様な症状」の定義に該当し
た副作用は 59 例 78 件であった。3 件以上報告された PT は、ワクチン接種部位疼痛
(30 件)
、感覚鈍麻(9 件)、倦怠感(6 件)
、頭痛、悪心、関節痛、四肢痛、発熱(各
3 件)だった。重篤は 2 件(PT: 倦怠感、ワクチン接種部位疼痛)で、76 件は非重篤だ
った。
「多様な症状」を発現した 59 例 78 件に関し検討した結果、新たな安全性の懸念
は認められなかった。
「多様な症状」発現症例のうち、やむを得ず調査終了とした事例が 9 例あるものの、
本活動の登録期間を通じて全体的に有害事象情報の報告が徹底され、フォローアップ
依頼に対して医師の協力も得られた。これは納入にあたり、あらかじめ接種医等に対
して「多様な症状」に関する注意喚起及び被接種者に「多様な症状」が発現した際のフ
ォローアップの徹底を依頼したのみならず、実際に接種医等による副作用発生時のフ
ォローアップの重要性への理解及び協力が得られたことで達成できたと考えられた。
また、接種医等による被接種者への事前説明等により、本剤接種前の段階から、
「多様
な症状」発現時に備えた各医療機関における被接種者との連絡体制も強化されたと考
えている。
詳細は全例登録による強化安全監視活動最終報告書の 3 項及び 6 項参照。
本活動により適切に接種の登録を行い、
「多様な症状」を発現した症例の把握を行った結
果、本活動で登録された被接種者に発現した副作用のうち、
「多様な症状」の定義に該当し
た副作用において本剤接種との関連性を示す根拠の集積はなく、新たな安全性の懸念は認
32