よむ、つかう、まなぶ。
資料2-10-2 シルガード9懸濁筋注シリンジ全例登録による強化安全監視活動最終報告書[1.9MB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00106.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第102回 7/29)医薬品等安全対策部会安全対策調査会(令和6年度第4回 7/29)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
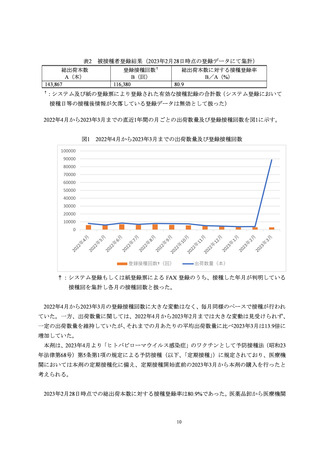
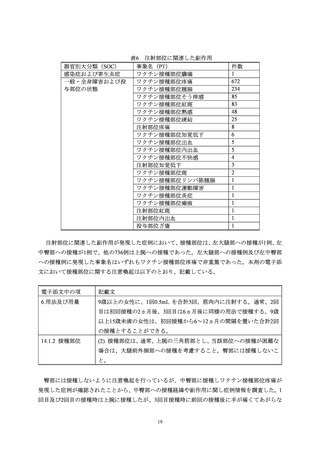
を得た。また有害事象の発現時には MSD 株式会社へ速やかに報告を行うことに加え、原則として
回復又は治療が必要なくなる状態になったことが確認できるまで、接種医等から被接種者と連絡を
取ることを依頼した(2.3 項参照)。
2.2
被接種者の登録
2.2.1
システムを利用した登録
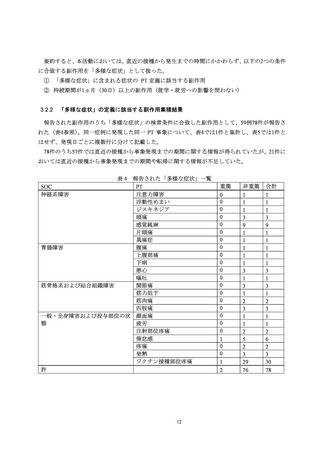
被接種者がスマートフォン等により、被接種者用システムの「ワクチン Q ダイアリー」に被接
種者情報(氏名、生年月日、連絡先等)を登録、続いて接種前確認事項等を入力し、その後、接種
医とシステム上の連携を行うことにより、接種医が被接種者の登録・入力情報を閲覧可能とした。
接種医は被接種者により入力された情報を確認して接種を行い、接種後には接種日時、接種部位等
の情報を入力した。この登録作業を接種ごとに行った。
なお、被接種者の個人情報については、システムの利用規約及び同意説明書に規定し、被接種者
の同意を取得した上で利用することとした。また、被接種者情報のうち個人情報に該当する情報に
ついては MSD 株式会社が閲覧できない仕様とし、個人情報の取扱いに関する問題は発生しなかっ
た。
2.2.2
紙の登録票を利用した登録
システムを利用した登録ができない場合は、接種医が紙媒体の登録票に、被接種者のイニシャル、
生年月日、予診票記載事項等を記入して、MSD 株式会社に FAX 送信することにより登録した。
なお、本活動と同時期に実施した本剤の一般使用成績調査又は有害事象報告により入手した症
例が、全例登録の登録症例と一致しなかった場合には、未登録症例として紙登録と同様の手続きを
行い、集計上は紙登録例として取り扱った。
2.3
有害事象の収集
MSD 株式会社から接種医に対して、本剤を医療機関へ納入する前の説明として以下の依頼を行
った。
本剤の各接種時に接種医は、有害な症状や病状がみられた際には連絡するよう被接種者に依
頼する。
接種医等は 1 回目接種後以降、有害事象発現の有無を確認する。
接種医等は有害事象を確認した場合、速やかに MSD 株式会社へ報告(自発報告)する。
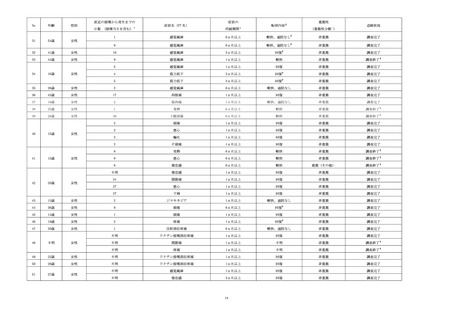
なお、有害事象の報告には2.2.1におけるシステム、又は2.2.2における紙の登録票は使用せず、通
常の安全性監視活動として GVP 省令に基づく製造販売後安全管理業務手順書に従い情報収集を行
った。また、収集した有害事象情報は全例登録システムを用いた管理は行わず、別途他の医薬品と
共通利用している既存の安全性管理システムにて管理を行った。
7
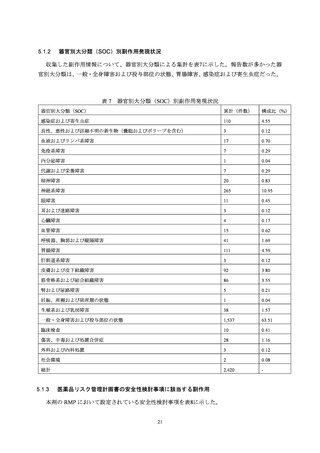
回復又は治療が必要なくなる状態になったことが確認できるまで、接種医等から被接種者と連絡を
取ることを依頼した(2.3 項参照)。
2.2
被接種者の登録
2.2.1
システムを利用した登録
被接種者がスマートフォン等により、被接種者用システムの「ワクチン Q ダイアリー」に被接
種者情報(氏名、生年月日、連絡先等)を登録、続いて接種前確認事項等を入力し、その後、接種
医とシステム上の連携を行うことにより、接種医が被接種者の登録・入力情報を閲覧可能とした。
接種医は被接種者により入力された情報を確認して接種を行い、接種後には接種日時、接種部位等
の情報を入力した。この登録作業を接種ごとに行った。
なお、被接種者の個人情報については、システムの利用規約及び同意説明書に規定し、被接種者
の同意を取得した上で利用することとした。また、被接種者情報のうち個人情報に該当する情報に
ついては MSD 株式会社が閲覧できない仕様とし、個人情報の取扱いに関する問題は発生しなかっ
た。
2.2.2
紙の登録票を利用した登録
システムを利用した登録ができない場合は、接種医が紙媒体の登録票に、被接種者のイニシャル、
生年月日、予診票記載事項等を記入して、MSD 株式会社に FAX 送信することにより登録した。
なお、本活動と同時期に実施した本剤の一般使用成績調査又は有害事象報告により入手した症
例が、全例登録の登録症例と一致しなかった場合には、未登録症例として紙登録と同様の手続きを
行い、集計上は紙登録例として取り扱った。
2.3
有害事象の収集
MSD 株式会社から接種医に対して、本剤を医療機関へ納入する前の説明として以下の依頼を行
った。
本剤の各接種時に接種医は、有害な症状や病状がみられた際には連絡するよう被接種者に依
頼する。
接種医等は 1 回目接種後以降、有害事象発現の有無を確認する。
接種医等は有害事象を確認した場合、速やかに MSD 株式会社へ報告(自発報告)する。
なお、有害事象の報告には2.2.1におけるシステム、又は2.2.2における紙の登録票は使用せず、通
常の安全性監視活動として GVP 省令に基づく製造販売後安全管理業務手順書に従い情報収集を行
った。また、収集した有害事象情報は全例登録システムを用いた管理は行わず、別途他の医薬品と
共通利用している既存の安全性管理システムにて管理を行った。
7