よむ、つかう、まなぶ。
資料2-10-2 シルガード9懸濁筋注シリンジ全例登録による強化安全監視活動最終報告書[1.9MB] (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00106.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第102回 7/29)医薬品等安全対策部会安全対策調査会(令和6年度第4回 7/29)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【販売名】
シルガード®9水性懸濁筋注シリンジ
【一般的名称】
組換え沈降9価ヒトパピローマウイルス様粒子ワクチン(酵母由来)
【承認(許可)番号】
30200AMX00746000
【承認(許可)年月日】
2020年7月21日
【薬効分類】 876313 ウイルスワクチン類
【販売開始年月日】
2021年2月24日
【登録期間】 2021年2月24日~2023年3月31日
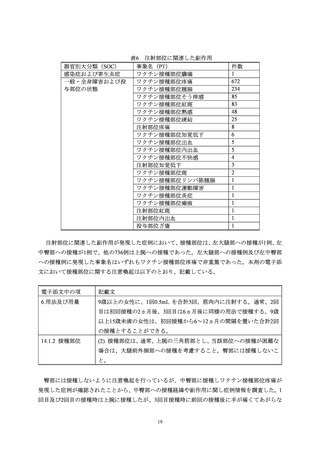
ワクチン接種後の好ましくない徴候、症状又は疾病等の表記には、「有害事象」、「副作用」、
「副
反応」及び「副反応疑い」等が状況に応じて使用されているが、本報告書における安全性情報は規
制当局への報告を行うことを主な目的として収集したものの集積であり、製造販売業者から規制当
局への報告であることを考慮し、ICH E2D ガイドラインに基づき「副作用」及び「有害事象」とい
った用語を用いることとする。ただし、個別には「副作用」として報告を行う症状であっても、症
例を集積した検討においてはワクチンとの因果関係がないと評価される症状等が含まれる可能性
がある。
製造販売業者等による適切な副作用等報告を確保するため ICH で合意した、副作用等報告に関す
る用語の定義と緊急報告のための基準が示されたガイドライン(E2D ガイドライン)では、「有害
事象」と「副作用」を以下のとおり定義している。
有害事象:有害事象とは、医薬品が投与された患者に生じたあらゆる好ましくない医療上の出来
事であり、必ずしも当該医薬品の投与との因果関係があるもののみを指すわけではな
い。すなわち、有害事象とは、医薬品の使用と時間的に関連のある、あらゆる好ましく
ない、意図しない徴候(例えば、臨床検査値の異常)、症状又は疾病のことであり、当
該医薬品との因果関係の有無は問わない。
副作用: 各地域の規制、行政指導及び慣例によって確立されているように、副作用とは医薬品に
対する有害で意図しない反応をいう。
「医薬品に対する反応」とは、医薬品と有害事象
との間に、少なくとも合理的な因果関係の可能性があるものをいう。有害事象とは異な
り、副作用とは、医薬品と事象の発生との因果関係が疑われるという事実を特徴とする。
有害事象が自発的に報告された場合は、たとえ因果関係について不明又は明確に述べ
られていなくても、規制当局への報告目的からすれば、副作用の定義を満たすことにな
る。
以下に、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(以下、薬機法)、
予防接種法、電子添文等におけるワクチン接種後の好ましくない徴候、症状又は疾病等の表記方法
を参考として記載する。
薬機法では、製造販売業者は「副作用」を報告することとなっている。
予防接種法の規定では医師等が接種後に一定の症状を呈していることを知った場合に、予防接
種後「副反応疑い」報告を行うことが規定されている。
ワクチン類等の電子添文では「副作用」を「副反応」と読み替えることが通知されている。
4
シルガード®9水性懸濁筋注シリンジ
【一般的名称】
組換え沈降9価ヒトパピローマウイルス様粒子ワクチン(酵母由来)
【承認(許可)番号】
30200AMX00746000
【承認(許可)年月日】
2020年7月21日
【薬効分類】 876313 ウイルスワクチン類
【販売開始年月日】
2021年2月24日
【登録期間】 2021年2月24日~2023年3月31日
ワクチン接種後の好ましくない徴候、症状又は疾病等の表記には、「有害事象」、「副作用」、
「副
反応」及び「副反応疑い」等が状況に応じて使用されているが、本報告書における安全性情報は規
制当局への報告を行うことを主な目的として収集したものの集積であり、製造販売業者から規制当
局への報告であることを考慮し、ICH E2D ガイドラインに基づき「副作用」及び「有害事象」とい
った用語を用いることとする。ただし、個別には「副作用」として報告を行う症状であっても、症
例を集積した検討においてはワクチンとの因果関係がないと評価される症状等が含まれる可能性
がある。
製造販売業者等による適切な副作用等報告を確保するため ICH で合意した、副作用等報告に関す
る用語の定義と緊急報告のための基準が示されたガイドライン(E2D ガイドライン)では、「有害
事象」と「副作用」を以下のとおり定義している。
有害事象:有害事象とは、医薬品が投与された患者に生じたあらゆる好ましくない医療上の出来
事であり、必ずしも当該医薬品の投与との因果関係があるもののみを指すわけではな
い。すなわち、有害事象とは、医薬品の使用と時間的に関連のある、あらゆる好ましく
ない、意図しない徴候(例えば、臨床検査値の異常)、症状又は疾病のことであり、当
該医薬品との因果関係の有無は問わない。
副作用: 各地域の規制、行政指導及び慣例によって確立されているように、副作用とは医薬品に
対する有害で意図しない反応をいう。
「医薬品に対する反応」とは、医薬品と有害事象
との間に、少なくとも合理的な因果関係の可能性があるものをいう。有害事象とは異な
り、副作用とは、医薬品と事象の発生との因果関係が疑われるという事実を特徴とする。
有害事象が自発的に報告された場合は、たとえ因果関係について不明又は明確に述べ
られていなくても、規制当局への報告目的からすれば、副作用の定義を満たすことにな
る。
以下に、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(以下、薬機法)、
予防接種法、電子添文等におけるワクチン接種後の好ましくない徴候、症状又は疾病等の表記方法
を参考として記載する。
薬機法では、製造販売業者は「副作用」を報告することとなっている。
予防接種法の規定では医師等が接種後に一定の症状を呈していることを知った場合に、予防接
種後「副反応疑い」報告を行うことが規定されている。
ワクチン類等の電子添文では「副作用」を「副反応」と読み替えることが通知されている。
4