よむ、つかう、まなぶ。
資料2-10-2 シルガード9懸濁筋注シリンジ全例登録による強化安全監視活動最終報告書[1.9MB] (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00106.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第102回 7/29)医薬品等安全対策部会安全対策調査会(令和6年度第4回 7/29)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
5.1.2
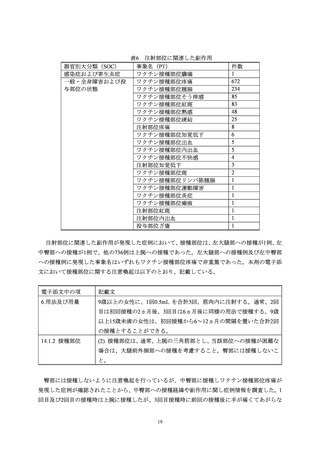
器官別大分類(SOC)別副作用発現状況
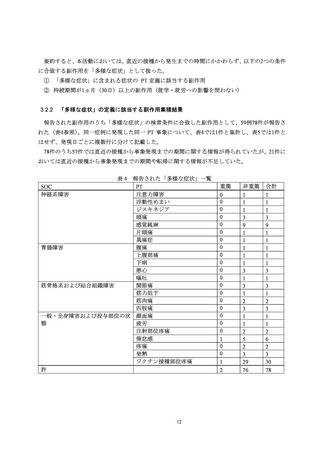
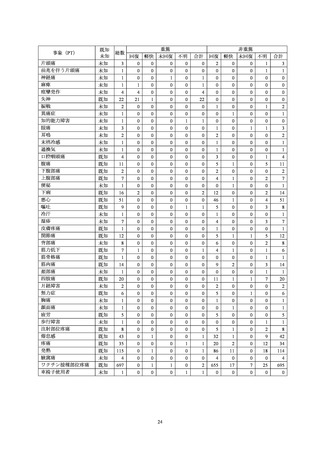
収集した副作用情報について、器官別大分類による集計を表7に示した。報告数が多かった器
官別大分類は、一般・全身障害および投与部位の状態、胃腸障害、感染症および寄生虫症だった。
表7
器官別大分類(SOC)別副作用発現状況
器官別大分類(SOC)
累計(件数)
構成比(%)
感染症および寄生虫症
110
4.55
良性、悪性および詳細不明の新生物(嚢胞およびポリープを含む)
3
0.12
血液およびリンパ系障害
17
0.70
免疫系障害
7
0.29
内分泌障害
1
0.04
代謝および栄養障害
7
0.29
精神障害
20
0.83
神経系障害
265
10.95
眼障害
11
0.45
耳および迷路障害
3
0.12
心臓障害
4
0.17
血管障害
15
0.62
呼吸器、胸郭および縦隔障害
41
1.69
胃腸障害
111
4.59
肝胆道系障害
3
0.12
皮膚および皮下組織障害
92
3.80
筋骨格系および結合組織障害
86
3.55
腎および尿路障害
5
0.21
妊娠、産褥および周産期の状態
1
0.04
生殖系および乳房障害
38
1.57
一般・全身障害および投与部位の状態
1,537
63.51
臨床検査
10
0.41
傷害、中毒および処置合併症
28
1.16
外科および内科処置
3
0.12
社会環境
2
0.08
総計
2,420
-
5.1.3
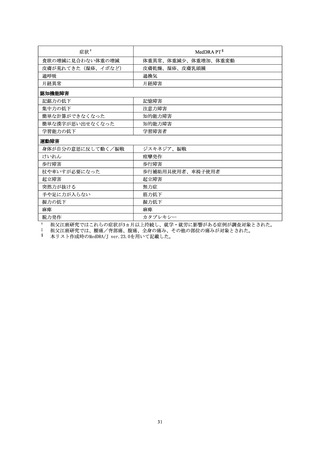
医薬品リスク管理計画書の安全性検討事項に該当する副作用
本剤の RMP において設定されている安全性検討事項を表8に示した。
21
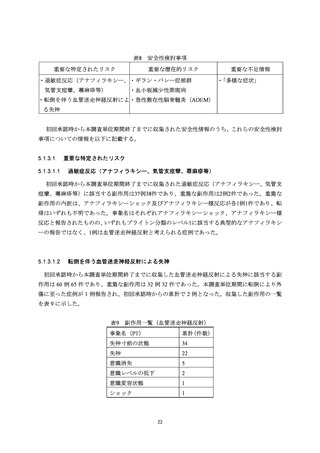
器官別大分類(SOC)別副作用発現状況
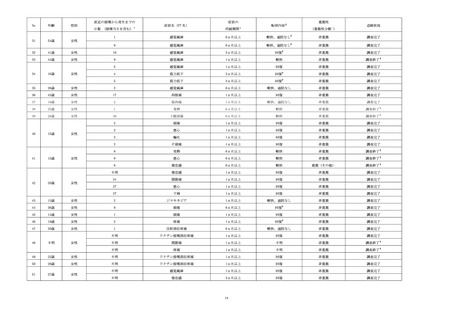
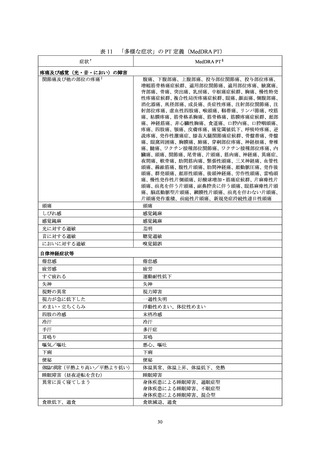
収集した副作用情報について、器官別大分類による集計を表7に示した。報告数が多かった器
官別大分類は、一般・全身障害および投与部位の状態、胃腸障害、感染症および寄生虫症だった。
表7
器官別大分類(SOC)別副作用発現状況
器官別大分類(SOC)
累計(件数)
構成比(%)
感染症および寄生虫症
110
4.55
良性、悪性および詳細不明の新生物(嚢胞およびポリープを含む)
3
0.12
血液およびリンパ系障害
17
0.70
免疫系障害
7
0.29
内分泌障害
1
0.04
代謝および栄養障害
7
0.29
精神障害
20
0.83
神経系障害
265
10.95
眼障害
11
0.45
耳および迷路障害
3
0.12
心臓障害
4
0.17
血管障害
15
0.62
呼吸器、胸郭および縦隔障害
41
1.69
胃腸障害
111
4.59
肝胆道系障害
3
0.12
皮膚および皮下組織障害
92
3.80
筋骨格系および結合組織障害
86
3.55
腎および尿路障害
5
0.21
妊娠、産褥および周産期の状態
1
0.04
生殖系および乳房障害
38
1.57
一般・全身障害および投与部位の状態
1,537
63.51
臨床検査
10
0.41
傷害、中毒および処置合併症
28
1.16
外科および内科処置
3
0.12
社会環境
2
0.08
総計
2,420
-
5.1.3
医薬品リスク管理計画書の安全性検討事項に該当する副作用
本剤の RMP において設定されている安全性検討事項を表8に示した。
21